题目内容
16.氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注.I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种方法即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验.
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较.
(2)0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.请解释化学反应速率变化的原因:随着反应的进行,浓度减小,反应速率减慢.请计算H2O2的初始物质的量浓度为0.11 mol/L(保留两位有效数字).
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无需写出具体操作):a.MnO2的质量有没有改变;b.MnO2的化学性质有没有改变.

分析 Ⅰ.(1)实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较;
(2)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答;
Ⅱ.(1)实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较;
(2)随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,根据2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑进行计算;根据催化剂在反应前后质量、化学性质不变解答.
解答 解:Ⅰ.(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中),
故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率;
Ⅱ.(1)通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较,
故答案为:单位时间生成O2的体积;生成单位体积O2所需要的时间;
(2)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,则:n(H2O2)=$\frac{0.06}{22.4}$×2≈0.00536 mol,
所以H2O2的初始物质的量浓度为:c(H2O2)=$\frac{0.00536}{0.05}$≈0.11 mol/L;
如果反应前后MnO2的质量有没有改变、MnO2的化学性质有没有改变,则证明MnO2在此实验中对H2O2的分解起催化作用,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;MnO2的质量有没有改变;MnO2的化学性质有没有改变.
点评 本题考查影响化学反应速率的因素,题目难度中等,试题能够较好的考查学生实验设计、数据处理、图象分析的综合能力,注意掌握温度、浓度、催化剂等因素对化学反应速率的影响.

| A. | 冰水 | B. | 海水 | C. | 盐水 | D. | 雨水 |
| A. | 海水、氯水、氨水均为混合物 | |
| B. | SiO2不能和水反应,所以它不是酸性氧化物 | |
| C. | 液氨、液态氯化氢都是非电解质 | |
| D. | 冰、干冰、冰醋酸都是电解质 |
| 选项 | 实验事实 | 结论 |
| A | 将二氧化硫通入溴水中,溴水褪色 | 二氧化硫有漂白性 |
| B | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 | 随溶液pH减小,“84”消毒液氧化能力增强 |
| C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸反应速率 |
| D | 淀粉与稀硫酸共热,再加银氨溶液水浴加热,无银镜生成 | 淀粉没有水解 |
| A. | A | B. | B | C. | C | D. | D |
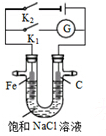
| A. | K1闭合,石墨棒上发生的反应为2H++2e→H2↑ | |
| B. | K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法 | |
| C. | K2闭合,石墨棒周围溶液pH逐渐升高 | |
| D. | K1闭合,电路中通过0.004NA个电子时,石墨棒上产生0.001mol气体 |
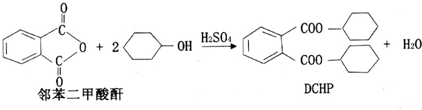
下列说法正确的是( )
| A. | DCHP的分子式为C20H28O4 | |
| B. | 上述制备DCHP的反应属于取代反应 | |
| C. | DCHP苯环上的一氯代物有4种 | |
| D. | 1 mol DCHP最多可与含4 mol NaOH的溶液反应 |
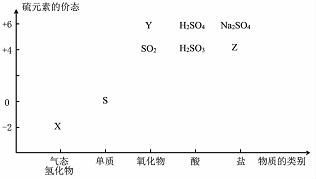 物质的类别和核心元素的化合价是研究物质性质的两个基本视角?
物质的类别和核心元素的化合价是研究物质性质的两个基本视角?(1)图中X的电子式为
 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱 (填“强”或“弱”)?用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱?
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱 (填“强”或“弱”)?用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱?(2)Na2S2O3是一种用途广泛的钠盐?
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是bd (填字母序号)?
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
②已知反应:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O?研究其反应速率时,下列说法正确的是b(填写字母序号)?
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度?温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO?SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体?
①已知:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1
S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1
则治理烟道气反应的热化学方程式为2CO(g)+SO2 (g)═S(s)+2CO2(g)△H=-270 kJ•mol-1?
②一定条件下,将CO与SO2以体积比为4:1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是cd (填写字母序号)?
a.v(CO):v(SO2)=2:1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为$\frac{7}{11}$,则SO2的转化率为60%?
(4)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇?甲醇可制作燃料电池?写出以氢氧化钾为电解质的甲醇燃料电池负极反应式CH3OH-6e-+8OH-=CO32-+6H2O?
(5)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表?
| 溶解度(s)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |

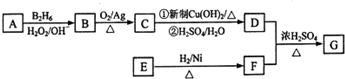
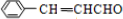 .
.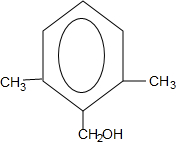 或
或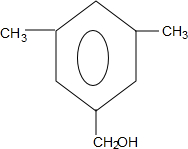 .
.