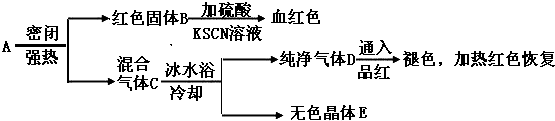
题目内容
11.如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( )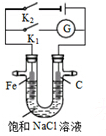
| A. | K1闭合,石墨棒上发生的反应为2H++2e→H2↑ | |
| B. | K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法 | |
| C. | K2闭合,石墨棒周围溶液pH逐渐升高 | |
| D. | K1闭合,电路中通过0.004NA个电子时,石墨棒上产生0.001mol气体 |
分析 若闭合K1,该装置没有外接电源,所以构成了原电池;组成原电池时,较活泼的金属铁作负极,负极上铁失电子发生氧化反应;石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应;若闭合K2,该装置有外接电源,所以构成了电解池,Fe与负极相连为阴极,碳棒与正极相连为阳极,据此判断.
解答 解:A、若闭合K1,该装置没有外接电源,所以构成了原电池,较活泼的金属铁作负极,负极上铁失电子,Fe-2e-=Fe2+,不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,故A错误;
B、K2闭合,Fe与负极相连为阴极,铁棒不会被腐蚀,属于外加电源的阴极保护法,故B正确;
C、K2闭合是电解池,石墨棒是阳极,氯离子放电,而在铁周围是氢离子放电,所以铁周围溶液pH逐渐升高,故C错误;
D、若闭合K1,该装置没有外接电源,所以构成了原电池;不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,无气体产生,故D错误.
故选B.
点评 本题考查了原电池原理和电解池原理,能正确判断电池的类型及两极的反应是解本题的关键,题目难度中等.

练习册系列答案
相关题目
1.科学家最近研究出一种环保、安全的制取金刚石的方法,其原理可表示为:4Na+3CO2$\frac{\underline{\;440℃高压\;}}{\;}$2Na2CO3+C,下列有关说法正确的是( )
| A. | 该反应为吸热反应 | B. | CO2中含α键又含π键 | ||
| C. | Na2CO3为离子晶体,只含离子键 | D. | 每消耗2.24LCO2生成0.4克金刚石 |
2.下列叙述中正确的是( )
| A. | CuSO4溶液、稀豆浆、硅酸都能产生丁达尔效应 | |
| B. | 将NaAlO2溶液蒸干后灼烧,所得固体产物为Al2O3 | |
| C. | 标准状况下,22.4L二氯甲烷中含σ键的数目为2.408×1024 | |
| D. | 室温下,7.0g乙烯和丁烯的混合气体中含有氢原子的数目为6.02×1023 |
19.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在反应中消耗0.1molCl2,转移的电子数一定为0.2NA | |
| B. | 15gCH3+(碳正离子)中含有的电子数为10NA | |
| C. | 标准状况下,0.5mol氦气含有的电子数为NA | |
| D. | 0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2NA |
16.氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注.
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种方法即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验.
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较.
(2)0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.请解释化学反应速率变化的原因:随着反应的进行,浓度减小,反应速率减慢.请计算H2O2的初始物质的量浓度为0.11 mol/L(保留两位有效数字).
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无需写出具体操作):a.MnO2的质量有没有改变;b.MnO2的化学性质有没有改变.

I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种方法即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验.
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较.
(2)0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.请解释化学反应速率变化的原因:随着反应的进行,浓度减小,反应速率减慢.请计算H2O2的初始物质的量浓度为0.11 mol/L(保留两位有效数字).
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无需写出具体操作):a.MnO2的质量有没有改变;b.MnO2的化学性质有没有改变.

3.下表中a、b、c表示相应仪器中加人的试剂,可用如图装置制取、净化、收集的气体是( )
| 编号 | 气体 | a | b | c | 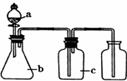 |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
| C | NO | 稀硝酸 | 铜屑 | H2O | |
| D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
| A. | A | B. | B | C. | C | D. | D |
1.四氢大麻酚具有抗癌、抗菌等作用,其结构简式如图所示.下列说法不正确的是( )

| A. | 每个四氢大麻酚分子中含有3个手性碳原子 | |
| B. | 四氢大麻酚能与FeCl3溶液发生显色反应 | |
| C. | 1mol四氢大麻酚最多可与1molBr2发生加成反应 | |
| D. | 1mol四氢大麻酚与NaOH溶液反应,最多消耗2molNaOH |



 ,B中的官能团名称是醛基、羟基.
,B中的官能团名称是醛基、羟基. .
. .
.