题目内容
7.下列有关物质分类的说法中,正确的是( )| A. | 海水、氯水、氨水均为混合物 | |
| B. | SiO2不能和水反应,所以它不是酸性氧化物 | |
| C. | 液氨、液态氯化氢都是非电解质 | |
| D. | 冰、干冰、冰醋酸都是电解质 |
分析 A、混合物是由不同物质组成的;
B、酸性氧化物能和碱反应生成盐和水,一般溶于水生成碱;
C、在水溶液里或熔融状态下都不导电的化合物是非电解质;在水溶液中或熔融状态下导电的化合物是电解质;
D、在水溶液中或熔融状态下导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质;常见的电解质有酸、碱、盐、金属氧化物和水.
解答 解:A、海水是各种盐的水溶液、氯水是氯气的水溶液、氨水为氨气的水溶液,均为混合物,故A正确;
B、SiO2能与碱反应生成盐和水:SiO2+2NaOH=Na2SiO3+H2O,属于酸性氧化物,故B错误;
C、液氨是非电解质,液态氯化氢是电解质,故C错误;
D、干冰的水溶液能导电,原因是干冰和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子而使溶液导电,碳酸是电解质,干冰是非电解质,冰和冰醋酸都是电解质,故D错误;
故选A.
点评 本题考查物质的分类,题目较为简单,掌握相关概念即可解答,学习中注意对概念的理解要准确.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
17.下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所对应的离子方程式正确的是
( )
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | K+、Fe3+、NO3-、SO42- | 少量KSCN | Fe3++3SCN-=Fe(SCN)3 |
| B | Na+、AlO2-、Cl-、OH- | 过量NaHCO3 | OH-+HCO3-=CO32-+H2O |
| C | H+、Ba2+、Al3+、HCO3- | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | K+、Na+、S2O32-、Cl- | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O2 |
| A. | A | B. | B | C. | C | D. | D |
18.如图是某反应的微观示意图,下列说法不正确的是( )
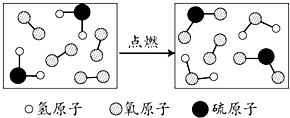

| A. | 反应物中有单质 | B. | 该反应为置换反应 | ||
| C. | 生成物的分子个数比为1:1 | D. | 化学反应前后原子的种类不变 |
2.下列叙述中正确的是( )
| A. | CuSO4溶液、稀豆浆、硅酸都能产生丁达尔效应 | |
| B. | 将NaAlO2溶液蒸干后灼烧,所得固体产物为Al2O3 | |
| C. | 标准状况下,22.4L二氯甲烷中含σ键的数目为2.408×1024 | |
| D. | 室温下,7.0g乙烯和丁烯的混合气体中含有氢原子的数目为6.02×1023 |
12.下列说法正确的是( )
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 除去苯中混有的少量苯酚,加入适量NaOH溶液,振荡、静置后分液 | |
| C. | 蛋白质溶液中加入硫酸铜溶液,有沉淀产生,加水,沉淀重新溶解 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
19.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在反应中消耗0.1molCl2,转移的电子数一定为0.2NA | |
| B. | 15gCH3+(碳正离子)中含有的电子数为10NA | |
| C. | 标准状况下,0.5mol氦气含有的电子数为NA | |
| D. | 0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2NA |
16.氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注.
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种方法即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验.
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较.
(2)0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.请解释化学反应速率变化的原因:随着反应的进行,浓度减小,反应速率减慢.请计算H2O2的初始物质的量浓度为0.11 mol/L(保留两位有效数字).
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无需写出具体操作):a.MnO2的质量有没有改变;b.MnO2的化学性质有没有改变.

I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种方法即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验.
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较.
(2)0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.请解释化学反应速率变化的原因:随着反应的进行,浓度减小,反应速率减慢.请计算H2O2的初始物质的量浓度为0.11 mol/L(保留两位有效数字).
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无需写出具体操作):a.MnO2的质量有没有改变;b.MnO2的化学性质有没有改变.

17.X、Y、Z、W为四种短周期元素.已知X、Y的原子得到两个电子形成稀有气体原子结构时,X放出的能量大于Y.Z、W的原子失去一个电子形成稀有气体原子结构时,W吸收的能量大于Z.则下列关于四种元素的说法正确的是( )
| A. | W、X两元素对应的单质发生反应只能得到W2X | |
| B. | 由X、Y、Z三种元素组成的物质其水溶液一定呈中性 | |
| C. | 1 mol Z2X2与足量水反应可得气体11.2 L | |
| D. | 四种元素在自然界中均以化合态存在 |
