题目内容
17.学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质: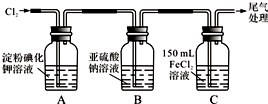
(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-.
(2)①通入氯气一段时间后,B瓶的溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验B瓶溶液中Cl-和SO42-的存在.
| 实 验 步 骤 | 预期现象和结论 |
| 步骤1:取适量B瓶中溶液于一干净试管中,滴加过量稀盐酸和适量的BaCl2溶液,振荡. | 若产生白色沉淀,则B瓶溶液中存在SO42-. |
步骤2:另取适量B瓶中溶液于试管一干净试管中,滴加过量的2mol/L HNO3和l mol/L Ba(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管中的上层清液于一干净试管中,滴加01mol/L AgNO3溶液,振荡. | 若产生白色沉淀,则B瓶溶液中存在Cl-. |
(3)为准确测定通入氯气一段时间后C瓶中剩余FeCl2的物质的量.实验如下:
①配制250mL 溶液:将C瓶中全部溶液取出盛于250mL容量瓶中,并准确配制成250mL溶液.
确保C瓶中的溶液全部取出(溶质无损失),需进行的操作是将C瓶中的溶液转移到容量瓶后,用少量蒸馏水洗涤C瓶2~3次,并转入容量瓶.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.20mol/L KMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应方程式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算:C瓶中剩余FeCl2的物质的量,n(FeCl2)=0.01Vmol.
分析 (1)A中氯气氧化碘离子生成碘单质,遇淀粉变蓝;C中氯气氧化亚铁离子;
(2)检验洗气瓶B溶液中Cl-和SO42-的存在,利用氯化钡、盐酸检验硫酸根离子;将硫酸根离子除去后利用硝酸和硝酸银检验氯离子;
(3)①配制溶液应把溶质全部转移到容量瓶中,利用洗涤C瓶几次一并转入容量瓶中;
②KMnO4溶液是强氧化性溶液,能腐蚀橡胶管分析;
③由5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O计算,注意量取溶液体积变化的计算.
解答 解:(1)A中氯气氧化碘离子生成碘单质,遇淀粉变蓝,则观察到A中溶液变蓝色,C中氯气氧化亚铁离子,则发生反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-;
故答案为:溶液变蓝色;2Fe2++Cl2═2Fe3++2Cl-;
(2)①检验洗气瓶B溶液中Cl-和SO42-的存在,利用氯化钡、盐酸检验硫酸根离子;将硫酸根离子除去后利用硝酸和硝酸银检验氯离子,则步骤与现象为
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量的稀盐酸和BaCl2 溶液振荡 | 若产生白色沉淀,则B瓶溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加过量的1mol/LLBa(NO3)2溶液,振荡、静置 | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加0.1mol/LAgNO3溶液和2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
| 实验步骤 | 预期现象和结论 |
| 过量的稀盐酸和BaCl2溶液 | |
| 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
故答案为:除去溶液中的SO32-和SO42-,防止对Cl-检测的干扰;
(3)①配制250mL 溶液:将C瓶中全部溶液取出盛于250mL容量瓶中,并准确配制成250mL溶液,确保C瓶中的溶液全部取出,溶质无损失,需要将C瓶中的溶液转移到容量瓶后,用少量蒸馏水洗涤C瓶2~3次,并转入容量瓶;
故答案为:将C瓶中的溶液转移到容量瓶后,用少量蒸馏水洗涤C瓶2~3次,并转入容量瓶;
②KMnO4溶液是强氧化性溶液,能腐蚀橡胶管,则应盛放在酸式滴定管中,故答案为:酸式滴定管;
③由5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
5 1
x v×0.001L×0.20mol/L
解得x=0.200mol/L×V×10-3 L×5mol=0.001Vmol,
则250mL溶液中FeCl2的物质的量为 $\frac{250}{25}$×0.001Vmol=0.01Vmol,
故答案为:0.01V.
点评 本题以氯气的性质为载体考查实验及成分的测定,把握离子的性质及发生的化学反应分析现象及计算为解答的关键,侧重学生分析能力、计算能力、知识迁移应用能力的综合考查,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.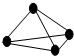 原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )
原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )
 原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )
原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |
8.N、Cu、H、O、S、Mg是常见的六种元素:
(1)Mg位于元素周期表第三周期第IIA族;N与O的基态原子核外未成对电子个数比为
3:2;Cu的基态原子电子排布式为1s22s22p63s23p63d104s1.
(2)用“>”或“<”填空:
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1mol H2SO4放热akJ,则该反应的热化学方程式为Mg3N2(S)+4H2SO4(aq)=3MgSO4(aq)+(NH4)2SO4(aq)△H=-4akJ/mol.
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽).写出该反应的化学方程式,并标出电子转移的方向和数目 .
.
(1)Mg位于元素周期表第三周期第IIA族;N与O的基态原子核外未成对电子个数比为
3:2;Cu的基态原子电子排布式为1s22s22p63s23p63d104s1.
(2)用“>”或“<”填空:
| 碱性: Mg (OH)2> Cu(OH)2 | 第一电离能:O< N | 熔点: MgS< MgO | 稳定性: H2S< H2O |
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽).写出该反应的化学方程式,并标出电子转移的方向和数目
 .
.
2.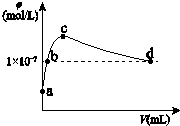 常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
 常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol/L | |
| B. | b点溶液中:c(H+)=1×10-7mol/L | |
| C. | c点溶液中:c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
9.X、Y、Z、R分别代表四种元素,若aXm+、bYn+、cZn-、dRm-四种离子的核外电子排布相同,且m>n,则下列关系正确的是( )
| A. | a-c=m-n | B. | b+d=m+n | C. | a>b>d>c | D. | a>b>c>d |
6.下列分子中所有原子一定处于同一平面的是( )
| A. | CH3CH2CH=CH2 | B. | CH2=CH-CH=CH2 | C. | C6H5-C≡CH | D. | CH3CH=CH2 |
7.常温下,下列对醋酸稀溶液的叙述中,正确的是( )
| A. | 将pH=a的醋酸稀释变为pH=a+1,醋酸的浓度则变为原来的$\frac{1}{10}$ | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$变小 | |
| C. | pH=a的醋酸与pH=a+1的醋酸分别中和等物质的量的NaOH溶液,二者所消耗体积比为1:10 | |
| D. | 等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14 |
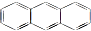 与苯炔(
与苯炔(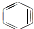 )反应生成化合物X(立体对称图形),如图所示:
)反应生成化合物X(立体对称图形),如图所示: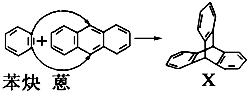
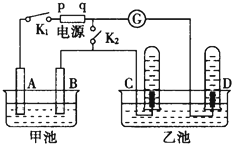 在如图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题:
在如图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题: