题目内容
7.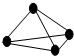 原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )
原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |
分析 观察分子结构图,一个原子与另外3个原子成键,形成3个共价键,再根据“8-N”规则判断.
解答 解:观察分子结构图,不难发现该分子中,一个原子与另外3个原子成键,形成3个共价键,再根据“8-N”规则,一个原子与相邻原子的成键数为8-N,有8-N=3,则N=5,即该元素位于第VA族.
故选C.
点评 本题考查元素周期表知识以及对新信息的摄取能力,图象的观察能力,有一定创新性,题目难度不大.

练习册系列答案
相关题目
3.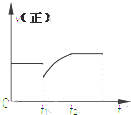 某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
 某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )| A. | 增大NH3浓度的同时减小N2浓度 | B. | 增大N2和H2的浓度 | ||
| C. | 扩大容器的体积 | D. | 降低反应温度 |
4.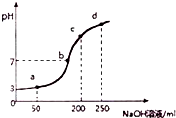 室温时,向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示,下列说法不正确的是( )
室温时,向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示,下列说法不正确的是( )
 室温时,向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示,下列说法不正确的是( )
室温时,向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示,下列说法不正确的是( )| A. | a、b、c、d四个点,水的电离程度最大的是a | |
| B. | b点溶液中存在c(SO42-)>c(Na+)>c(NH4+) | |
| C. | 在0.1mol?L-1NH4Al(SO4)2溶液中:c(NH4+)+3c(Al3+)=0.199 mol?L-1 | |
| D. | 滴加NaOH溶液期间,溶液中NH4+与SO42-浓度之和始终为0.2mol?L-1 |
1.向BaCl2溶液中通入物质的量之比为1:2的某混合气体,无沉淀产生,则该混合气体是( )
| A. | Cl2和SO2 | B. | CO2 和NH3 | C. | NO和CO2 | D. | NO2 和SO2 |
12.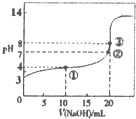 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )| A. | 根据图中数据可计算出K值约为1×10-5 | |
| B. | ①②③点水的电离程度由大到小的顺序为:②>③>① | |
| C. | 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 点③时c(CH3COOH)+(CH3COO-)=0.1mol/L |
19.化学与工农业生产和人类生活密切相关.下列说法中正确的是( )
| A. | 明矾与漂白粉常用于自来水的净化与消毒,这两者的作用原理是一样的 | |
| B. | 为了防止中秋月饼的富脂食物因被氧化而变质,常在包装袋里放生石灰 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀,该方法叫牺牲阳极的阴极保护法 | |
| D. | 酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的 |
17.学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
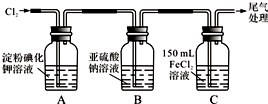
(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-.
(2)①通入氯气一段时间后,B瓶的溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验B瓶溶液中Cl-和SO42-的存在.
②实验步骤2的目的是:除去溶液中的SO32-和SO42-,防止对Cl-检测的干扰.
(3)为准确测定通入氯气一段时间后C瓶中剩余FeCl2的物质的量.实验如下:
①配制250mL 溶液:将C瓶中全部溶液取出盛于250mL容量瓶中,并准确配制成250mL溶液.
确保C瓶中的溶液全部取出(溶质无损失),需进行的操作是将C瓶中的溶液转移到容量瓶后,用少量蒸馏水洗涤C瓶2~3次,并转入容量瓶.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.20mol/L KMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应方程式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算:C瓶中剩余FeCl2的物质的量,n(FeCl2)=0.01Vmol.

(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-.
(2)①通入氯气一段时间后,B瓶的溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验B瓶溶液中Cl-和SO42-的存在.
| 实 验 步 骤 | 预期现象和结论 |
| 步骤1:取适量B瓶中溶液于一干净试管中,滴加过量稀盐酸和适量的BaCl2溶液,振荡. | 若产生白色沉淀,则B瓶溶液中存在SO42-. |
步骤2:另取适量B瓶中溶液于试管一干净试管中,滴加过量的2mol/L HNO3和l mol/L Ba(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管中的上层清液于一干净试管中,滴加01mol/L AgNO3溶液,振荡. | 若产生白色沉淀,则B瓶溶液中存在Cl-. |
(3)为准确测定通入氯气一段时间后C瓶中剩余FeCl2的物质的量.实验如下:
①配制250mL 溶液:将C瓶中全部溶液取出盛于250mL容量瓶中,并准确配制成250mL溶液.
确保C瓶中的溶液全部取出(溶质无损失),需进行的操作是将C瓶中的溶液转移到容量瓶后,用少量蒸馏水洗涤C瓶2~3次,并转入容量瓶.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.20mol/L KMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应方程式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算:C瓶中剩余FeCl2的物质的量,n(FeCl2)=0.01Vmol.
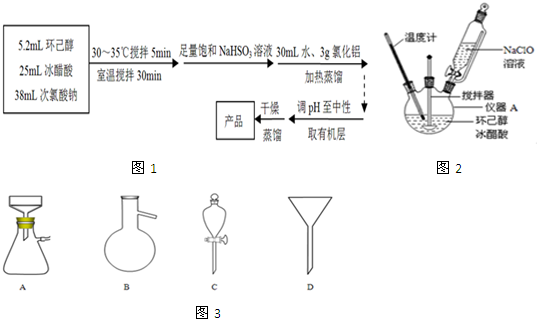

 有机物A(C10H20O2)具有兰花香味,可用于香皂、洗发香波的芳香剂.A可通过如图所示的转化关系而制得.
有机物A(C10H20O2)具有兰花香味,可用于香皂、洗发香波的芳香剂.A可通过如图所示的转化关系而制得. .
.