题目内容
9.X、Y、Z、R分别代表四种元素,若aXm+、bYn+、cZn-、dRm-四种离子的核外电子排布相同,且m>n,则下列关系正确的是( )| A. | a-c=m-n | B. | b+d=m+n | C. | a>b>d>c | D. | a>b>c>d |
分析 四种离子的核外电子数相同,阳离子的原子序数大于阴离子,阳离子的质子数-电荷数=电子数,阴离子的质子数+电荷数=电子数,阳离子所带电荷数越大,原子序数越大,阴离子所带电荷数越大,原子序数越小,以此来解答.
解答 解:aXm+、bYn+、cZn-、dRm-四种离子的核外电子排布相同,即核外电子数相等,所以a-m=b-n=c+n=d+m,则a-c=m+n,b-d=m+n;核外电子数相同,阳离子的原子序数大于阴离子,阳离子所带电荷数越大,原子序数越大,阴离子所带电荷数越大,原子序数越小,所以原子序数为:a>b>c>d;
故选D.
点评 本题考查离子的电子数计算,明确阳离子失去电子、阴离子得到电子及四种离子的核外电子数相同时原子序数的关系即可解答,难度一般.

练习册系列答案
相关题目
19.化学与工农业生产和人类生活密切相关.下列说法中正确的是( )
| A. | 明矾与漂白粉常用于自来水的净化与消毒,这两者的作用原理是一样的 | |
| B. | 为了防止中秋月饼的富脂食物因被氧化而变质,常在包装袋里放生石灰 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀,该方法叫牺牲阳极的阴极保护法 | |
| D. | 酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的 |
20.下列相关实验的操作或结论正确的是( )
| A. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 | |
| B. | 制硝基苯时温度计水银球在反应液中 | |
| C. | 实验室制乙烯时温度计水银球在反应液中 | |
| D. | 检验溴乙烷中的溴元素时,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,滴加AgNO3溶液 |
17.学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
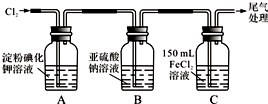
(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-.
(2)①通入氯气一段时间后,B瓶的溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验B瓶溶液中Cl-和SO42-的存在.
②实验步骤2的目的是:除去溶液中的SO32-和SO42-,防止对Cl-检测的干扰.
(3)为准确测定通入氯气一段时间后C瓶中剩余FeCl2的物质的量.实验如下:
①配制250mL 溶液:将C瓶中全部溶液取出盛于250mL容量瓶中,并准确配制成250mL溶液.
确保C瓶中的溶液全部取出(溶质无损失),需进行的操作是将C瓶中的溶液转移到容量瓶后,用少量蒸馏水洗涤C瓶2~3次,并转入容量瓶.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.20mol/L KMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应方程式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算:C瓶中剩余FeCl2的物质的量,n(FeCl2)=0.01Vmol.

(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-.
(2)①通入氯气一段时间后,B瓶的溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验B瓶溶液中Cl-和SO42-的存在.
| 实 验 步 骤 | 预期现象和结论 |
| 步骤1:取适量B瓶中溶液于一干净试管中,滴加过量稀盐酸和适量的BaCl2溶液,振荡. | 若产生白色沉淀,则B瓶溶液中存在SO42-. |
步骤2:另取适量B瓶中溶液于试管一干净试管中,滴加过量的2mol/L HNO3和l mol/L Ba(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管中的上层清液于一干净试管中,滴加01mol/L AgNO3溶液,振荡. | 若产生白色沉淀,则B瓶溶液中存在Cl-. |
(3)为准确测定通入氯气一段时间后C瓶中剩余FeCl2的物质的量.实验如下:
①配制250mL 溶液:将C瓶中全部溶液取出盛于250mL容量瓶中,并准确配制成250mL溶液.
确保C瓶中的溶液全部取出(溶质无损失),需进行的操作是将C瓶中的溶液转移到容量瓶后,用少量蒸馏水洗涤C瓶2~3次,并转入容量瓶.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.20mol/L KMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应方程式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算:C瓶中剩余FeCl2的物质的量,n(FeCl2)=0.01Vmol.
4.关于化学键的下列叙述中,正确的是( )
| A. | 离子化合物中可能含共价键 | B. | 共价化合物中可能含离子键 | ||
| C. | 离子化合物中不含共价键 | D. | 共价化合物中不含离子键 |
14.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 1mol甲基(-CH3)所含的电子总数为7NA | |
| D. | 现有乙烯.丙烯.丁烯的混合气体共14g,其原子数为3NA |
18.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 15g甲基所含有的电子数是10NA个 | |
| B. | 1mol苯乙烯中含有的碳、碳双键数为4NA个 | |
| C. | 标准状况下,1L庚烷所含有的分子数为NA/22.4 | |
| D. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
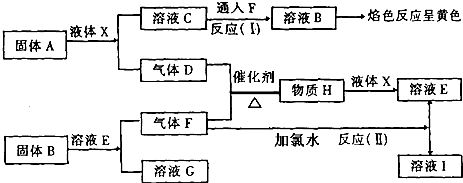
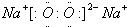
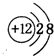 .
.