题目内容
2.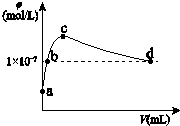 常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol/L | |
| B. | b点溶液中:c(H+)=1×10-7mol/L | |
| C. | c点溶液中:c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
分析 a点为单一氢氧化钠溶液,a到c是生成碳酸钠,b点是碳酸钠和氢氧化钠的混合溶液,c点是单一的碳酸钠溶液,c到d是生成碳酸氢钠,d点是碳酸氢钠和碳酸的混合溶液,d点溶液呈中性,由此分析解答.
A、水电离出的氢离子与氢氧根离子的浓度始终相等,a是没有通二氧化碳的情况,即pH=10的 NaOH溶液,结合水的离子积常数分析求解;
B、b点是强碱溶液对水的电离起抑制作用,所以溶液中的c(H+)<1×10-7mol/L;
C、当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钠溶液,对水的电离起促进作用;
D、d点溶液中水电离出的OH-离子浓度10-7mol/L,溶液呈中性,结合电荷守恒分析解答.
解答 解:A、水电离出的氢离子与氢氧根离子的浓度始终相等,a是没有通二氧化碳的情况,即pH=10的 NaOH溶液,则c(H+)=1×10-10mol/L,而氢离子来源于水的电离,所以水电离出的c(H+)=1×10-10mol/L,故A正确;
B、b点是强碱溶液对水的电离起抑制作用,所以溶液中的c(H+)<1×10-7mol/L,故B错误;
C、当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钠溶液,对水的电离起促进作用,所以离子溶液浓度大小为c(Na+)>c(CO32-)>c(HCO3-),故C正确;
D、d点溶液中水电离出的OH-离子浓度10-7mol/L,溶液呈中性,c(H+)=c(OH-),结合电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),两式相减,得c(Na+)=2c(CO32-)+c(HCO3-),故D正确;
故选B.
点评 本题考查混合物的计算、图象数据的处理知等,难度中等,根据图象判断溶质及各段发生的反应是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.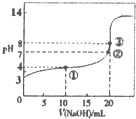 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )| A. | 根据图中数据可计算出K值约为1×10-5 | |
| B. | ①②③点水的电离程度由大到小的顺序为:②>③>① | |
| C. | 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 点③时c(CH3COOH)+(CH3COO-)=0.1mol/L |
13.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | 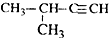 2-甲基-3-丁炔 | B. | 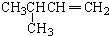 3-甲基丁烯 | C. | 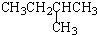 2-甲基丁烷 | D. | 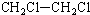 二氯乙烷 |
17.学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
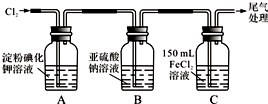
(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-.
(2)①通入氯气一段时间后,B瓶的溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验B瓶溶液中Cl-和SO42-的存在.
②实验步骤2的目的是:除去溶液中的SO32-和SO42-,防止对Cl-检测的干扰.
(3)为准确测定通入氯气一段时间后C瓶中剩余FeCl2的物质的量.实验如下:
①配制250mL 溶液:将C瓶中全部溶液取出盛于250mL容量瓶中,并准确配制成250mL溶液.
确保C瓶中的溶液全部取出(溶质无损失),需进行的操作是将C瓶中的溶液转移到容量瓶后,用少量蒸馏水洗涤C瓶2~3次,并转入容量瓶.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.20mol/L KMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应方程式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算:C瓶中剩余FeCl2的物质的量,n(FeCl2)=0.01Vmol.

(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-.
(2)①通入氯气一段时间后,B瓶的溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验B瓶溶液中Cl-和SO42-的存在.
| 实 验 步 骤 | 预期现象和结论 |
| 步骤1:取适量B瓶中溶液于一干净试管中,滴加过量稀盐酸和适量的BaCl2溶液,振荡. | 若产生白色沉淀,则B瓶溶液中存在SO42-. |
步骤2:另取适量B瓶中溶液于试管一干净试管中,滴加过量的2mol/L HNO3和l mol/L Ba(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管中的上层清液于一干净试管中,滴加01mol/L AgNO3溶液,振荡. | 若产生白色沉淀,则B瓶溶液中存在Cl-. |
(3)为准确测定通入氯气一段时间后C瓶中剩余FeCl2的物质的量.实验如下:
①配制250mL 溶液:将C瓶中全部溶液取出盛于250mL容量瓶中,并准确配制成250mL溶液.
确保C瓶中的溶液全部取出(溶质无损失),需进行的操作是将C瓶中的溶液转移到容量瓶后,用少量蒸馏水洗涤C瓶2~3次,并转入容量瓶.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.20mol/L KMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应方程式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算:C瓶中剩余FeCl2的物质的量,n(FeCl2)=0.01Vmol.
14.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 1mol甲基(-CH3)所含的电子总数为7NA | |
| D. | 现有乙烯.丙烯.丁烯的混合气体共14g,其原子数为3NA |
11.某温度下,向pH=6的纯水中加入一定量的氢氯酸,保持温度不变,测得溶液的pH=3,对于该溶液,下列叙述中不正确的是( )
| A. | pH=6的纯水呈中性 | |
| B. | 该溶液的浓度c(HCl)=0.001 mol•L-1 | |
| C. | 该溶液中水电离产生的c(H+)=10-9 mol•L-1 | |
| D. | 该温度下,加入等体积的pH=11NaOH溶液,即可恰好完全中和 |
12.下列有关叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温材料的元素 | |
| C. | 在金属元素区域中可以寻找制备新型农药材料的元素 | |
| D. | 23592U可用作核反应堆的燃料,21H与31H可用作制造氢弹的原料 |
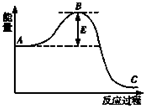 工业合成氨N2+3H2?2NH3反应过程中的能量变化如图所示,据图回答下列问题:
工业合成氨N2+3H2?2NH3反应过程中的能量变化如图所示,据图回答下列问题: