题目内容
5.蒽(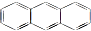 与苯炔(
与苯炔(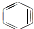 )反应生成化合物X(立体对称图形),如图所示:
)反应生成化合物X(立体对称图形),如图所示: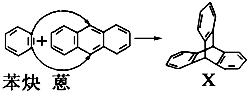
(1)蒽与X都属于ac(填选项,下同).
A.环烃 B.烷烃 C.芳香烃
(2)苯炔的分子式为C6H4,苯炔不具有的性质是ad.
A.能溶于水 B.能发生氧化反应
C.能发生加成反应 D.常温常压下为气体
(3)1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列AD事实.
A.苯不能使溴水褪色
B.苯能与H2发生加成反应
C.溴苯没有同分异构体
D.邻二溴苯只有一种
现代化学认为苯分子碳碳之间的键是大π键.
(4)下列属于苯的同系物的是D.
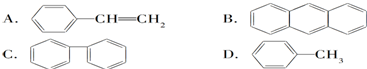
(5)能发生加成反应,也能发生取代反应,同时能使溴水因反应而褪色,也能使酸性高锰酸钾溶液褪色的是D.
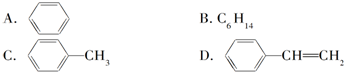
分析 (1)只含C、H元素的有机物属于烃,含有环的烃属于环烃,含有苯环的烃属于芳香烃;
(2)苯炔的分子式为C6H4;苯炔属于有机物,不溶于水,为液体,具有碳碳三键,具有炔的性质;
(3)如果苯具有碳碳单键和双键交替,碳碳双键能和溴水发生加成反应,邻二溴苯应该有同分异构体;
(4)结构相似,分子组成相差一个或n个-CH2原子团的有机物属于同系物;
(5)能发生加成反应属于含有苯环或不饱和键,也能发生取代反应,同时能使溴水因反应而褪色属于含有不饱和键,也能使酸性高锰酸钾溶液褪色,含有不饱和键或为连接苯环的碳原子上有氢原子的苯的同系物.
解答 解:(1)只含C、H元素的有机物属于烃,含有环的烃属于环烃,含有苯环的烃属于芳香烃,所以蒽与X都属于环烃、芳香烃,故选ac;
(2)苯炔的分子式为C6H4;
A.属于有机物且没有亲水基,所以不能溶于水,故错误;
B.为有机物且含有碳碳三键,能发生氧化反应,故正确;
C.含有碳碳双键及三键,所以能发生加成反应,故正确;
D.碳原子个数大于4,常温常压下为液体,故错误;
故答案为:C6H4;ad;
(3)A.1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,如果含有C=C键的话,则能发生加成反应而使溴水褪色,但真实的情况是苯不能使溴水应发生反应而褪色,这一点不能解释,故A选;
B.苯是单、双键交替的正六边形平面结构,故苯能与H2发生加成反应,故B不选;
C.因为苯上的氢原子都是等效氢原子,所以溴取代它们中的哪一个氢原子都是一样的,所以没有同分异构体
,故C不选;
D.如果是单双键交替的正六边形平面结构,则邻二溴苯应有Br-C-C-Br和Br-C=C-Br两种不同的结构,但事实是邻二溴苯只有一种,故D选;
故选AD;现代化学认为苯分子碳碳之间的键是大π键,
故答案为:AD;大π键;
(4)结构相似,分子组成相差一个或n个-CH2原子团的有机物属于同系物,只有甲苯属于苯的同系物,故选D;
(5)能发生加成反应属于含有苯环或不饱和键,也能发生取代反应,同时能使溴水因反应而褪色属于含有不饱和键,也能使酸性高锰酸钾溶液褪色,含有不饱和键或为连接苯环的碳原子上有氢原子的苯的同系物,
所以符合条件的只有苯乙烯,故选D.
点评 本题考查有机物结构和性质、甲苯概念等知识点,明确物质中官能团及其性质关系是解本题关键,知道同系物的判断方法,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | Cl2和SO2 | B. | CO2 和NH3 | C. | NO和CO2 | D. | NO2 和SO2 |
| A. | 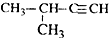 2-甲基-3-丁炔 | B. | 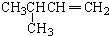 3-甲基丁烯 | C. | 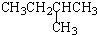 2-甲基丁烷 | D. | 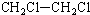 二氯乙烷 |
| A. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 | |
| B. | 制硝基苯时温度计水银球在反应液中 | |
| C. | 实验室制乙烯时温度计水银球在反应液中 | |
| D. | 检验溴乙烷中的溴元素时,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,滴加AgNO3溶液 |
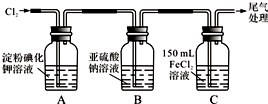
(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-.
(2)①通入氯气一段时间后,B瓶的溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验B瓶溶液中Cl-和SO42-的存在.
| 实 验 步 骤 | 预期现象和结论 |
| 步骤1:取适量B瓶中溶液于一干净试管中,滴加过量稀盐酸和适量的BaCl2溶液,振荡. | 若产生白色沉淀,则B瓶溶液中存在SO42-. |
步骤2:另取适量B瓶中溶液于试管一干净试管中,滴加过量的2mol/L HNO3和l mol/L Ba(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管中的上层清液于一干净试管中,滴加01mol/L AgNO3溶液,振荡. | 若产生白色沉淀,则B瓶溶液中存在Cl-. |
(3)为准确测定通入氯气一段时间后C瓶中剩余FeCl2的物质的量.实验如下:
①配制250mL 溶液:将C瓶中全部溶液取出盛于250mL容量瓶中,并准确配制成250mL溶液.
确保C瓶中的溶液全部取出(溶质无损失),需进行的操作是将C瓶中的溶液转移到容量瓶后,用少量蒸馏水洗涤C瓶2~3次,并转入容量瓶.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.20mol/L KMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应方程式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算:C瓶中剩余FeCl2的物质的量,n(FeCl2)=0.01Vmol.
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 1mol甲基(-CH3)所含的电子总数为7NA | |
| D. | 现有乙烯.丙烯.丁烯的混合气体共14g,其原子数为3NA |
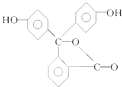
| A. | 酚酞与水可以形成氢键 | |
| B. | 酚酞的分子式为C20H14O4 | |
| C. | 酚酞结构中含有羟基(-OH),故酚酞属于醇 | |
| D. | 酚酞在一定条件下能够发生加成反应 |
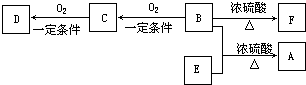 有机物A(C10H20O2)具有兰花香味,可用于香皂、洗发香波的芳香剂.A可通过如图所示的转化关系而制得.
有机物A(C10H20O2)具有兰花香味,可用于香皂、洗发香波的芳香剂.A可通过如图所示的转化关系而制得. .
.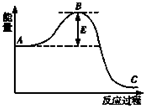 工业合成氨N2+3H2?2NH3反应过程中的能量变化如图所示,据图回答下列问题:
工业合成氨N2+3H2?2NH3反应过程中的能量变化如图所示,据图回答下列问题: