题目内容
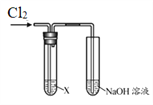
【题目】某学习小组用下图装置研究Cl2的性质。
| 序号 | X | 实验现象 |
Ⅰ | AgNO3溶液 | 现象a | |
Ⅱ | 淀粉碘化钾溶液 | 溶液变蓝 | |
Ⅲ | 紫色石蕊溶液 | 溶液先变红后褪色 | |
Ⅳ | Na2SO3溶液 | 无明显现象 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断Cl2的化学性质是______。
(3)根据实验Ⅲ,结合化学方程式说明产生现象的原因:______。
(4)实验Ⅳ中无现象,如何证明反应发生了,简述实验方案______。
(5)结合离子方程式说明实验中NaOH溶液的作用是______。
【答案】 白色沉淀 氧化性 Cl2+H2O ![]() HCl+HClO ,盐酸具有酸性,能使紫色石蕊溶液变红;次氯酸具有强氧化性(或漂白性),能使石蕊溶液褪色 取反应后溶液,向其中先滴加盐酸,使溶液呈酸性,再滴加氯化钡溶液,若有白色沉淀生成,则证明氯气和亚硫酸钠溶液发生了反应 尾气吸收,Cl2+2OH-
HCl+HClO ,盐酸具有酸性,能使紫色石蕊溶液变红;次氯酸具有强氧化性(或漂白性),能使石蕊溶液褪色 取反应后溶液,向其中先滴加盐酸,使溶液呈酸性,再滴加氯化钡溶液,若有白色沉淀生成,则证明氯气和亚硫酸钠溶液发生了反应 尾气吸收,Cl2+2OH- ![]() Cl-+ClO-+H2O
Cl-+ClO-+H2O
【解析】(1)根据氯气具有强氧化性,溶于水生成盐酸和次氯酸以及氯气属于大气污染物结合问题分析解答。
(1)氯气通入硝酸银溶液中生成氯化银白色沉淀,所以实验Ⅰ中,现象a是产生白色沉淀。
(2)溶液变蓝,说明有单质碘生成,这是由于氯气具有强氧化性,把碘化钾氧化为单质碘,碘遇淀粉显蓝色。
(3)氯气溶于水发生反应Cl2+H2O=HCl+HClO,盐酸具有酸性,能使紫色石蕊溶液变红;次氯酸具有强氧化性(或漂白性),能使石蕊溶液褪色,所以氯气通入紫色石蕊试液中溶液先变红后褪色。
(4)氯气能把亚硫酸钠氧化为硫酸钠,可以通过检验硫酸根离子证明反应发生了,即取反应后溶液,向其中先滴加盐酸,使溶液呈酸性,再滴加氯化钡溶液,若有白色沉淀生成,则证明氯气和亚硫酸钠溶液发生了反应。
(5)氯气有毒,属于大气污染物,需要尾气处理,发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案【题目】下表列出8种元素在元素周期表中的位置,结合所学内容回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出①的元素符号_________, 元素⑥的原子结构示意图____________________。
(2)写出元素⑤的最高价氧化物对应的水化物的电子式_____________, 该化合物中含有的化学键是_____________________。
(3)H元素分别与②、③、④形成的最稳定的气态氢化物是______________(写氢化物的化学式)。
(4)⑦、⑧是两种常见的非金属元素,从原子结构分析,原子半径⑦_______⑧(填写“>”或“<”);得电子能力较强是________ (填写元素符号);非金属性强弱关系是⑦_______⑧(填写“>”或“<”);⑧的单质通入⑦的钠盐溶液中,出现黄色沉淀,其离子方程式为_________________________________。
(5)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止;
③锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4。
该同学查找三种元素在周期表的位置如图所示:
Ⅳ | |
4 | Ge |
5 | Sn |
6 | Pb |
请解释产生上述性质变化的原因______________________________________。