题目内容
【题目】下表列出8种元素在元素周期表中的位置,结合所学内容回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出①的元素符号_________, 元素⑥的原子结构示意图____________________。
(2)写出元素⑤的最高价氧化物对应的水化物的电子式_____________, 该化合物中含有的化学键是_____________________。
(3)H元素分别与②、③、④形成的最稳定的气态氢化物是______________(写氢化物的化学式)。
(4)⑦、⑧是两种常见的非金属元素,从原子结构分析,原子半径⑦_______⑧(填写“>”或“<”);得电子能力较强是________ (填写元素符号);非金属性强弱关系是⑦_______⑧(填写“>”或“<”);⑧的单质通入⑦的钠盐溶液中,出现黄色沉淀,其离子方程式为_________________________________。
(5)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止;
③锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4。
该同学查找三种元素在周期表的位置如图所示:
Ⅳ | |
4 | Ge |
5 | Sn |
6 | Pb |
请解释产生上述性质变化的原因______________________________________。
【答案】 Li 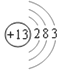
![]() 共价键 离子键 H2O > Cl < Cl2+S2-=2Cl-+S 锗、锡、铅随着原子序数的增多,原子半径逐渐增大,失电子能力逐渐增强,金属性逐渐增强
共价键 离子键 H2O > Cl < Cl2+S2-=2Cl-+S 锗、锡、铅随着原子序数的增多,原子半径逐渐增大,失电子能力逐渐增强,金属性逐渐增强
【解析】分析:首先根据8种元素在元素周期表的位置,判断出元素的名称,然后结合元素周期律、相关物质的性质、题干中的问题分析解答。
详解:根据8种元素在元素周期表的位置可知①~⑧分别是Li、C、N、O、Na、Al、S、Cl。则
(1)①是锂,元素符号为Li,元素⑥是Al,原子结构示意图为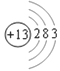 。
。
(2)元素⑤的最高价氧化物对应的水化物是氢氧化钠,含有离子键和共价键的离子化合物,电子式为![]() 。
。
(3)非金属性越强,氢化物越稳定,非金属性是C<N<O,则H元素分别与②、③、④形成的最稳定的气态氢化物是H2O。
(4)同周期自左向右原子半径逐渐减小,原子核对外层电子的吸引力逐渐增强,因此原子半径是S>Cl,得电子能力较强是Cl,非金属性强弱关系是S<Cl;⑧的单质通入⑦的钠盐溶液中,出现黄色沉淀,原因是氯气把硫离子氧化为单质硫,则其离子方程式为Cl2+S2-=2Cl-+S。
(5)根据题干信息可知锗、锡、铅的金属性逐渐增强,这是由于锗、锡、铅位于同一主族,随着原子序数的增多,原子半径逐渐增大,失电子能力逐渐增强,因此金属性逐渐增强。

 名校课堂系列答案
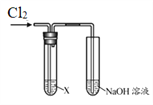
名校课堂系列答案【题目】某学习小组用下图装置研究Cl2的性质。
| 序号 | X | 实验现象 |
Ⅰ | AgNO3溶液 | 现象a | |
Ⅱ | 淀粉碘化钾溶液 | 溶液变蓝 | |
Ⅲ | 紫色石蕊溶液 | 溶液先变红后褪色 | |
Ⅳ | Na2SO3溶液 | 无明显现象 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断Cl2的化学性质是______。
(3)根据实验Ⅲ,结合化学方程式说明产生现象的原因:______。
(4)实验Ⅳ中无现象,如何证明反应发生了,简述实验方案______。
(5)结合离子方程式说明实验中NaOH溶液的作用是______。