题目内容
【题目】用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用.例如:计算机芯片的主要成分是________;光导纤维的主要成分是________; 人们使用量最大的传统硅酸盐产品有水泥、玻璃和________
【答案】硅 二氧化硅 陶瓷
【解析】
硅为良好的半导体,是计算机芯片的主要成分;光导纤维的主要成分为二氧化硅;人们使用量最大的传统硅酸盐产品有水泥、玻璃和陶瓷。

【题目】以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2 + 4Fe3+ ![]() Cu2+ + 5Fe2+ + 2S。
Cu2+ + 5Fe2+ + 2S。
(1)该反应中,Fe3+体现________性。
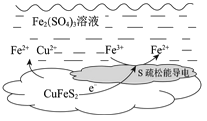
(2)上述总反应的原理如图所示。
负极的电极反应式是________。
(3)一定温度下,控制浸取剂pH = 1,取三份相同质量黄铜矿粉末分别进行如下实验:
实验 | 操作 | 2小时后Cu2+浸出率/% |
I | 加入足量0.10 mol·L-1 Fe2(SO4)3溶液 | 78.2 |
II | 加入足量0.10 mol·L-1 Fe2(SO4)3溶液,通入空气 | 90.8 |
III | 加入足量0.10 mol·L-1 Fe2(SO4)3溶液,再加入少量0.0005 mol·L-1 Ag2SO4溶液 | 98.0 |
①对比实验I、II,通入空气,Cu2+浸出率提高的原因是________。
②由实验III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+==Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+==2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005 mol·L-1 Ag2SO4溶液,充分混合后静置。取上层清液,加入稀盐酸,观察到溶液中________,证明发生反应i。
b.取少量Ag2S粉末,加入________溶液,充分混合后静置。取上层清液,加入稀盐酸,有白色沉淀,证明发生反应ii。
(4)用实验II的浸取液电解提取铜的原理如图所示:
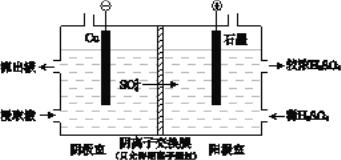
① 电解初期,阴极没有铜析出。用电极反应式解释原因是_______________。
② 将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是 _____________________。
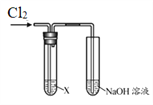
【题目】某学习小组用下图装置研究Cl2的性质。
| 序号 | X | 实验现象 |
Ⅰ | AgNO3溶液 | 现象a | |
Ⅱ | 淀粉碘化钾溶液 | 溶液变蓝 | |
Ⅲ | 紫色石蕊溶液 | 溶液先变红后褪色 | |
Ⅳ | Na2SO3溶液 | 无明显现象 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断Cl2的化学性质是______。
(3)根据实验Ⅲ,结合化学方程式说明产生现象的原因:______。
(4)实验Ⅳ中无现象,如何证明反应发生了,简述实验方案______。
(5)结合离子方程式说明实验中NaOH溶液的作用是______。