题目内容
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。
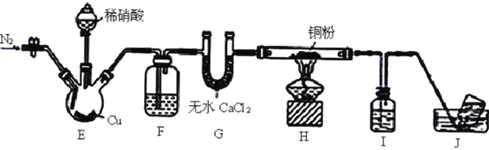
已知:在溶液中.FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
A. 装置F、I中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 装置J收集的气体中一定不含NO
【答案】D
【解析】稀硝酸与铜反应生成一氧化氮,能够被氧气氧化,因此实验前需要通入氮气,排除装置中的空气,硝酸具有挥发性,生成的一氧化氮中混有少量硝酸蒸气,可以通过水吸收后再干燥,在探究干燥的一氧化氮在加热时与铜的反应,未反应的NO可以利用硫酸亚铁溶液检验。A.根据上述分析,装置F、I中的试剂依次为水、硫酸亚铁溶液,故A正确;B. 若观察到装置H中红色粉末变黑色,数目NO与Cu发生了反应,故B正确;C. 实验结束后,为了防止倒吸,需要先熄灭酒精灯,再关闭分液漏斗的活塞,停止通入NO,故C正确;D. 由于FeSO4+NO![]() [Fe(NO)]SO4(棕色)为可逆反应,装置J收集的气体中可能含有NO,故D错误;故选D。
[Fe(NO)]SO4(棕色)为可逆反应,装置J收集的气体中可能含有NO,故D错误;故选D。

 口算题卡加应用题集训系列答案
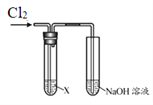
口算题卡加应用题集训系列答案【题目】某学习小组用下图装置研究Cl2的性质。
| 序号 | X | 实验现象 |
Ⅰ | AgNO3溶液 | 现象a | |
Ⅱ | 淀粉碘化钾溶液 | 溶液变蓝 | |
Ⅲ | 紫色石蕊溶液 | 溶液先变红后褪色 | |
Ⅳ | Na2SO3溶液 | 无明显现象 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断Cl2的化学性质是______。
(3)根据实验Ⅲ,结合化学方程式说明产生现象的原因:______。
(4)实验Ⅳ中无现象,如何证明反应发生了,简述实验方案______。
(5)结合离子方程式说明实验中NaOH溶液的作用是______。