题目内容
【题目】我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( ) 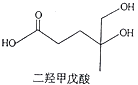
A.与乙醇发生酯化反应生成产物的分子式为C8H18O4
B.能发生加成反应,不能发生取代反应
C.在铜的催化下与氧气反应的产物可以发生银镜反应
D.标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2
【答案】C
【解析】解:A.只有﹣COOH可与乙醇发生酯化反应,由原子守恒可知,与乙醇发生酯化反应生成产物的分子式为C8H16O4 , 故A错误;
B.含﹣COOH,不能发生加成反应,故B错误;
C.含﹣OH,﹣CH2OH在铜的催化下与氧气反应的产物含﹣CHO可以发生银镜反应,故C正确;
D.﹣COOH、﹣OH均与钠反应生成氢气,则标准状况下1mol该有机物可以与足量金属钠反应产生1.5mol×22.4L/mol=33.6LH2 , 故D错误;
故选C.
【考点精析】关于本题考查的有机物的结构和性质,需要了解有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解才能得出正确答案.

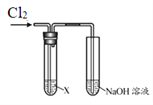
【题目】某学习小组用下图装置研究Cl2的性质。
| 序号 | X | 实验现象 |
Ⅰ | AgNO3溶液 | 现象a | |
Ⅱ | 淀粉碘化钾溶液 | 溶液变蓝 | |
Ⅲ | 紫色石蕊溶液 | 溶液先变红后褪色 | |
Ⅳ | Na2SO3溶液 | 无明显现象 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断Cl2的化学性质是______。
(3)根据实验Ⅲ,结合化学方程式说明产生现象的原因:______。
(4)实验Ⅳ中无现象,如何证明反应发生了,简述实验方案______。
(5)结合离子方程式说明实验中NaOH溶液的作用是______。
【题目】利用低品位软锰矿浆(主要成分是MnO2,少量的Fe3+、Al3+等)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体可实现资源的综合利用和环境治理。
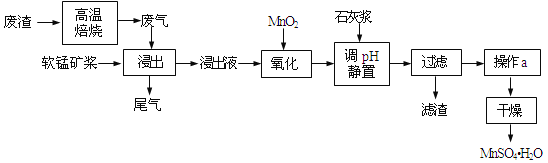
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时的pH见表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
Fe2+ | 7.6 | 9.7 | |
Fe3+ | 2.7 | 3.7 | |
Al3+ | 3.8 | 4.7 | >8.5 |
Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式_____________________________。为了提高软锰矿的浸取率,可以采取的措施除了充分搅拌外还有:_____________________(至少答两点)。
(2)写出氧化过程中主要反应的离子方程式:_____________________________。
(3)①在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至______。②若加入的石灰浆过多,会使得MnSO4H2O晶体中含有较多杂质,其原因是_____________________________。
(4)下列各组试剂中,能准确测定尾气中SO2含量的是______(选填序号)。
a.NaOH溶液、品红溶液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液