ЬтФПФкШн
ЁОЬтФПЁПЗЧН№ЪєЕЅжЪAОШчЭМЫљЪОЕФЙ§ГЬзЊЛЏЮЊКЌбѕЫсDЃЌвбжЊDЮЊЧПЫсЃЌЧыЛиД№ЯТСаЮЪЬтЁЃ
![]()
![]()
![]()
![]()
![]()
![]()
![]()
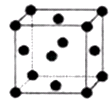
ЃЈ1ЃЉШєAдкГЃЮТЯТЮЊЙЬЬхЃЌBЪЧФмЪЙЦЗКьШмвКЭЪЩЋЕФгаДЬМЄадЦјЮЖЕФЮоЩЋЦјЬх:
ЂйDЕФЛЏбЇЪНЪЧ________ЃЛ
ЂкдкЙЄвЕЩњВњжаЃЌBЦјЬхЕФДѓСПХХЗХБЛгъЫЎЮќЪеКѓаЮГЩСЫ________ЖјЮлШОСЫЛЗОГЁЃ
ЃЈ2ЃЉШєAдкГЃЮТЯТЮЊЦјЬхЃЌCЪЧКьзиЩЋЕФЦјЬх:
ЂйAЁЂCЕФЛЏбЇЪНЗжБ№ЪЧЃКA________ЃЛC________ЁЃ
ЂкDЕФХЈШмвКдкГЃЮТЯТПЩгыЭЗДгІВЂЩњГЩCЦјЬхЃЌЧыаДГіИУЗДгІЕФЛЏбЇЗНГЬЪН_______________________________________________ЁЃИУЗДгІ________(ЬюЁАЪєгкЁБЛђЁАВЛЪєгкЁБ)бѕЛЏЛЙдЗДгІЁЃ
ЁОД№АИЁП H2SO4 Ысгъ N2 NO2 CuЃЋ4HNO3(ХЈ)===Cu(NO3)2ЃЋ2NO2ЁќЃЋ2H2O Ъєгк
ЁОНтЮіЁПЗЧН№ЪєЕЅжЪAЃЌзЊЛЏЮЊКЌбѕЫсDЃЌDЮЊЧПЫсЃЌBКЭCЖМЪЧбѕЛЏЮяЃЌдђAдЊЫиЮЊПЩБфМлдЊЫиЃЌЗћКЯЬѕМўЕФдЊЫигаSЁЂNдЊЫиЃЌдђAЪЧЕЊЦјЛђСђЕЅжЪЁЃ(1)ШєAдкГЃЮТЯТЮЊЙЬЬхЃЌдђAЪЧSЕЅжЪЃЌBЪЧФмЪЙЦЗКьШмвКЭЪЩЋЕФгаДЬМЄадЦјЮЖЕФЮоЩЋЦјЬхЃЌдђBЪЧSO2ЃЌЖўбѕЛЏСђБЛбѕЛЏЩњГЩШ§бѕЛЏСђЃЌдђCЪЧSO3ЃЌШ§бѕЛЏСђКЭЫЎЗДгІЩњГЩСђЫсЃЌдђDЪЧH2SO4ЃЌЂйЭЈЙ§вдЩЯЗжЮіжЊЃЌDЪЧСђЫсЃЌЦфЛЏбЇЪНЮЊЃКH2SO4ЃЛЂкBЪЧЖўбѕЛЏСђЃЌЖўбѕЛЏСђКЭЫЎЗДгІЩњГЩбЧСђЫсЃЌбЧСђЫсВЛЮШЖЈвзБЛбѕЛЏЩњГЩСђЫсЃЌСђЫсШмвКГЪЫсадЃЌгъЫЎжаКЌгаСђЫсЖјаЮГЩЫсгъЃЛ(2)ШєAдкГЃЮТЯТЮЊЦјЬхЃЌCЪЧКьзиЩЋЦјЬхЃЌдђAЪЧN2ЃЌCЪЧNO2ЃЌBЪЧNOЃЌDЪЧHNO3ЁЃЂйЭЈЙ§вдЩЯЗжЮіжЊЃЌAЁЂCЕФЛЏбЇЪНЗжБ№ЪЧЃКN2ЁЂNO2ЃЛЂкГЃЮТЯТЃЌЭКЭХЈЯѕЫсЗДгІЩњГЩЯѕЫсЭЁЂЖўбѕЛЏЕЊКЭЫЎЃЌЗДгІЗНГЬЪНЮЊCuЃЋ4HNO3(ХЈ)ЃНCu(NO3)2ЃЋ2NO2ЁќЃЋ2H2OЃЌЗДгІжаЭКЭЕЊдЊЫиЛЏКЯМлБфЛЏЃЌЪєгкбѕЛЏЛЙдЗДгІЁЃ

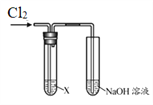
ЁОЬтФПЁПФГбЇЯАаЁзщгУЯТЭМзАжУбаОПCl2ЕФаджЪЁЃ
| ађКХ | X | ЪЕбщЯжЯѓ |
Ђё | AgNO3ШмвК | ЯжЯѓa | |
Ђђ | ЕэЗлЕтЛЏМиШмвК | ШмвКБфРЖ | |
Ђѓ | зЯЩЋЪЏШяШмвК | ШмвКЯШБфКьКѓЭЪЩЋ | |
Ђє | Na2SO3ШмвК | ЮоУїЯдЯжЯѓ |
ЧыЛиД№ЃК
ЃЈ1ЃЉЪЕбщЂёжаЃЌЯжЯѓaЪЧ______ЁЃ
ЃЈ2ЃЉИљОнЪЕбщЂђЃЌЭЦЖЯCl2ЕФЛЏбЇаджЪЪЧ______ЁЃ
ЃЈ3ЃЉИљОнЪЕбщЂѓЃЌНсКЯЛЏбЇЗНГЬЪНЫЕУїВњЩњЯжЯѓЕФдвђЃК______ЁЃ
ЃЈ4ЃЉЪЕбщЂєжаЮоЯжЯѓЃЌШчКЮжЄУїЗДгІЗЂЩњСЫЃЌМђЪіЪЕбщЗНАИ______ЁЃ
ЃЈ5ЃЉНсКЯРызгЗНГЬЪНЫЕУїЪЕбщжаNaOHШмвКЕФзїгУЪЧ______ЁЃ
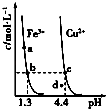
ЁОЬтФПЁПРћгУЕЭЦЗЮЛШэУЬПѓНЌЃЈжївЊГЩЗжЪЧMnO2ЃЌЩйСПЕФFe3+ЁЂAl3+ЕШЃЉЮќЪеИпЮТБКЩеКЌСђЗЯдќВњЩњЕФSO2ЗЯЦјЃЌжЦБИСђЫсУЬОЇЬхПЩЪЕЯжзЪдДЕФзлКЯРћгУКЭЛЗОГжЮРэЁЃ
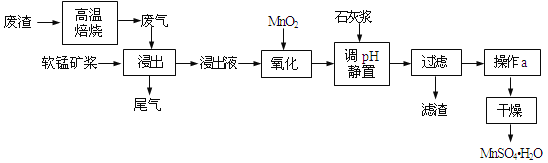
вбжЊЃЌНўГівКЕФpHЃМ2ЃЌЦфжаЕФН№ЪєРызгжївЊЪЧMn2+ЃЌЛЙКЌгаЩйСПЕФFe2+ЁЂAl3+ЕШЦфЫћН№ЪєРызгЁЃгаЙиН№ЪєРызгаЮГЩЧтбѕЛЏЮяГСЕэЪБЕФpHМћБэЃК
Рызг | ПЊЪМГСЕэЪБЕФpH | ЭъШЋГСЕэЪБЕФpH | МгМюШмНтЕФpH |
Fe2+ | 7.6 | 9.7 | |
Fe3+ | 2.7 | 3.7 | |
Al3+ | 3.8 | 4.7 | >8.5 |
Mn2+ | 8.3 | 9.8 |
ЃЈ1ЃЉаДГіНўГіЙ§ГЬжажївЊЗДгІЕФЛЏбЇЗНГЬЪН_____________________________ЁЃЮЊСЫЬсИпШэУЬПѓЕФНўШЁТЪЃЌПЩвдВЩШЁЕФДыЪЉГ§СЫГфЗжНСАшЭтЛЙгаЃК_____________________ЃЈжСЩйД№СНЕуЃЉЁЃ
ЃЈ2ЃЉаДГібѕЛЏЙ§ГЬжажївЊЗДгІЕФРызгЗНГЬЪНЃК_____________________________ЁЃ
ЃЈ3ЃЉЂйдкбѕЛЏКѓЕФвКЬхжаМгШыЪЏЛвНЌЃЌгУгкЕїНкpHЃЌpHгІЕїНкжС______ЁЃЂкШєМгШыЕФЪЏЛвНЌЙ§ЖрЃЌЛсЪЙЕУMnSO4H2OОЇЬхжаКЌгаНЯЖрдгжЪЃЌЦфдвђЪЧ_____________________________ЁЃ
ЃЈ4ЃЉЯТСаИїзщЪдМСжаЃЌФмзМШЗВтЖЈЮВЦјжаSO2КЌСПЕФЪЧ______ЃЈбЁЬюађКХЃЉЁЃ
a.NaOHШмвКЁЂЦЗКьШмвК b.ЯЁH2SO4ЫсЛЏЕФKMnO4ШмвК c.ЕтЫЎЁЂЕэЗлШмвК