题目内容
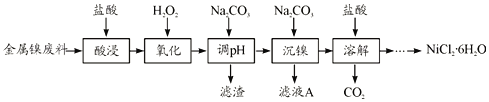
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。
【答案】将镍废料磨成粉末(或搅拌,或适当升高温度,或提高酸的浓度) H2O2+2Fe2++2H+=2Fe3++2H2O 4.7≤pH<7.1或[4.7,7.1) 17.5 蒸发浓缩、冷却结晶
【解析】
根据流程:金属镍废料(含Fe、Al等杂质),加盐酸酸浸后的酸性溶液中主要含有H+、Ni2+、Fe2+、Al3+,加入过氧化氢氧化亚铁离子为铁离子,反应为:H2O2+2Fe2++2H+=2Fe3++2H2O,加入Na2CO3溶液调节溶液的pH范围4.7≤pH<7.1,使Fe3+、Al3+全部沉淀,滤渣为Fe(OH)3、Al(OH)3,滤液主要含有Ni2+,加入Na2CO3溶液沉淀Ni2+,将得到的NiCO3沉淀用盐酸溶解得到二氧化碳和NiCl2溶液,将NiCl2溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到NiCl26H2O,据此分析作答。
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有将镍废料磨成粉末、搅拌、适当升高温度方法、提高溶液中酸的浓度,都可以提高镍元素的浸出率;
(2)H2O2具有氧化性,加入H2O2氧化Fe2+为Fe3+,离子方程式为: H2O2+2Fe2++2H+=2Fe3++2H2O;
(3)“调pH”的目的是沉淀Fe3+、Al3+,但不沉淀Ni2+,根据表格数据可知,应该控制溶液pH的范围为4.7≤pH<7.1或[4.7,7.1);
(4)滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中含有n(Ni2+)=0.1mol,则生成NiCO3需要CO32-为0.1mol,Ni2+刚好沉淀完全时,溶液中c(CO32-)=![]() =0.65mol/L,此时溶液中CO32-为0.065mol,故至少需要Na2CO3固体0.1mol+0.065mol=0.165mol,其质量m(Na2CO3)=0.165mol×106g/mol=17.49g≈17.5g;
=0.65mol/L,此时溶液中CO32-为0.065mol,故至少需要Na2CO3固体0.1mol+0.065mol=0.165mol,其质量m(Na2CO3)=0.165mol×106g/mol=17.49g≈17.5g;
(5)将NiCl2溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到NiCl26H2O。

【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
1173 K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=_________。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=_________。
(3)能判断反应③已达平衡状态的是_________。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式_________。据此关系式及上表数据,也能推断出反应③是____________(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是_______(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量