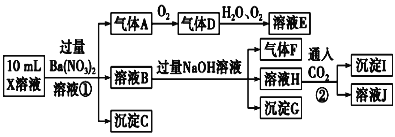
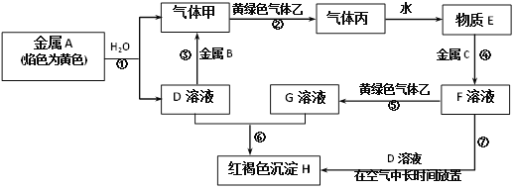
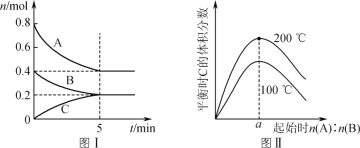
题目内容
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )

A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
【答案】A
【解析】
Y元素原子的外围电子排布为nsn1npn+1,s能级最多容纳2个电子,故n1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,Y为S元素,由X、Y、Z在周期表中的位置可知,X为F元素,Z为As元素。
A.Y元素原子的外围电子排布为nsn1npn+1,s能级最多容纳2个电子,故n1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,故A错误;
B.Y为S元素,处于第三周期第ⅥA族,故B正确;
C.X为F元素,处于第二周期,只有2两种金属元素,含有6种非金属元素,含非金属元素最多,故C正确;
D.Z为As元素,是33号元素,其元素原子的核外电子排布式为![]() ,故D正确;
,故D正确;
答案选A。

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目