题目内容
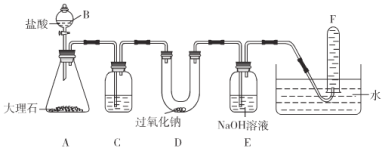
【题目】实验室用一定量MnO2固体与足量浓盐酸在加热条件下充分反应制取2.24L标准状况下的氯气,其反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,,(相对原子质量O-16,Mn-55)
MnCl2+Cl2↑+2H2O,,(相对原子质量O-16,Mn-55)
试计算:
(1)参加反应的MnO2的质量____________;
(2)反应后溶液的体积为100mL,溶液中MnCl2的物质的量浓度____________。
【答案】8.7g 1mol/L
【解析】
(1)标况下2.24L氯气的物质的量为![]() =0.1mol,根据方程式可知制取0.1mol氯气需要0.1molMnO2,其质量为0.1mol×87g/mol=8.7g;
=0.1mol,根据方程式可知制取0.1mol氯气需要0.1molMnO2,其质量为0.1mol×87g/mol=8.7g;
(2)根据方程式可知生成0.1mol氯气时生成的氯化锰为0.1mol,溶液体积为100mL,所以氯化锰的浓度为![]() =1mol/L。
=1mol/L。

【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:
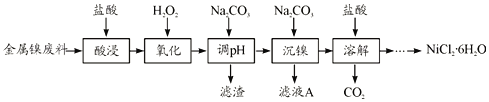
下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。
【题目】已知常温下部分弱电解质的电离常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | Ka=6.8×10-4 | Ka=4.7×10-8 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Kb=1.7×10-5 |
(1)常温下,物质的量浓度相同的四种溶液:①HF溶液;②HClO溶液;③NaHCO3溶液;④NH3·H2O溶液,其pH由大到小的顺序是____________(填字母)。
(2)25 ℃时,pH=4的NH4Cl溶液与pH=4的HF溶液中由水电离出的c(H+)之比为________。
(3)0.1 mol·L-1NaClO溶液和0.1 mol·L-1NaHCO3溶液中,c(ClO-) ______ c(![]() )(填>、<或=);可使上述两种溶液pH相等的方法是________(填字母)。
)(填>、<或=);可使上述两种溶液pH相等的方法是________(填字母)。
A.向NaClO溶液中加适量水
B.向NaClO溶液中加入适量NaOH固体
C.向NaHCO3溶液中加适量水
D.向NaHCO3溶液中加适量NaOH固体
(4)向NaClO溶液中通入少量CO2,所发生反应的离子方程式为:__________________________。
(5)常温下,计算NH4Cl溶液中,![]() 的水解常数Kh=_________________。
的水解常数Kh=_________________。