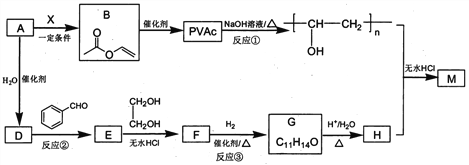
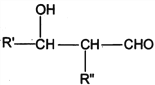
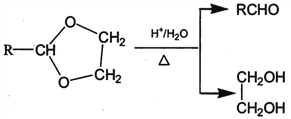
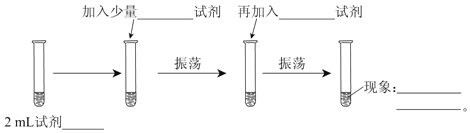
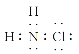题目内容
【题目】下列事实与对应的方程式不符合的是
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH>-57.4 kJ·mol-1
B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)(红棕色)![]() N2O4 (g)(无色) ΔH<0
N2O4 (g)(无色) ΔH<0
C.甲烷的燃烧热为-890.3 kJ·mol—1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1
D.硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+=S↓+SO2 ↑+H2O
【答案】C
【解析】
A.醋酸电离为吸热过程,稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l),放出的热量小于57.4kJ/mol,ΔH>-57.4 kJ·mol-1,故A正确;
B.因2NO2(g)(红棕色)N2O4(g)(无色) △H<0,该反应为放热反应,在冷水中该反应向正反应方向移动,气体的颜色变浅,故B正确;
C.液态水更稳定,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJmol-1,故C错误;
D.硫代硫酸钠溶液与稀硫酸混合反应生成硫、二氧化硫和水,离子方程式:S2O32-+2H+═S↓+SO2↑+H2O,故D正确;
故选C。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:
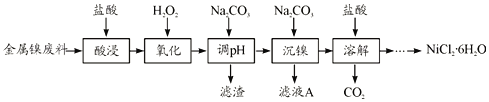
下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。