题目内容
【题目】时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域.测定含![]() 浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是
浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是
①在中性溶液中,用溴将试样中![]() 氧化成
氧化成![]() ,将过量的溴除去
,将过量的溴除去
②再加入过量的碘化钾,在酸性条件下,使![]() 完全转化成
完全转化成![]()
③将②中生成的碘完全萃取后,用肼将其还原成![]() ,方程式为
,方程式为![]()
④将生成的![]() 萃取到水层后用
萃取到水层后用![]() 法处理
法处理
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化
⑥将⑤反应后的溶液以淀粉作指示剂,用![]() 标准溶液滴定,方程式为:
标准溶液滴定,方程式为:![]()
经过上述放大后,则溶液中![]() 浓度放大为原溶液中
浓度放大为原溶液中![]() 浓度的(设放大前后溶液体积相等)
浓度的(设放大前后溶液体积相等)
A.2倍B.4倍C.6倍D.36倍
【答案】D
【解析】
①第一步反应的离子方程式为I-+3Br2+3H2O=6Br-+IO3-+6H+,由方程式可知1个I-生成1个IO3-,I原子个数没有变化;
②第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O,由方程式可知1个IO3-生成3个I2,与①相比I原子个数放大了6倍;
③第三步反应的离子方程式为N2H4+2I2=4I-+N2↑+4H+,由方程式可知1个I2生成2个I-,与②相比I原子个数没有变化;
④第四步反应的离子方程式为I-+3Br2+3H2O=6Br-+IO3-+6H+,由方程式可知1个I-生成1个IO3-,与③相比I原子个数没有变化;
⑤第五步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O,由方程式可知1个IO3-生成3个I2,与④相比I原子个数放大了6倍;
⑥第六步反应的离子方程式为2S2O32-+I2=S4O62-+2I-,由方程式可知1个I2生成2个I-,与⑤相比I原子个数没有变化;
则⑥与①相比,I原子个数放大了6×6=36倍,即I-浓度放大了36倍,故选D。

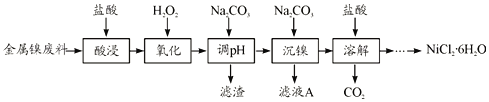
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。
【题目】已知常温下部分弱电解质的电离常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | Ka=6.8×10-4 | Ka=4.7×10-8 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Kb=1.7×10-5 |
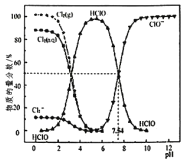
(1)常温下,物质的量浓度相同的四种溶液:①HF溶液;②HClO溶液;③NaHCO3溶液;④NH3·H2O溶液,其pH由大到小的顺序是____________(填字母)。
(2)25 ℃时,pH=4的NH4Cl溶液与pH=4的HF溶液中由水电离出的c(H+)之比为________。
(3)0.1 mol·L-1NaClO溶液和0.1 mol·L-1NaHCO3溶液中,c(ClO-) ______ c(![]() )(填>、<或=);可使上述两种溶液pH相等的方法是________(填字母)。
)(填>、<或=);可使上述两种溶液pH相等的方法是________(填字母)。
A.向NaClO溶液中加适量水
B.向NaClO溶液中加入适量NaOH固体
C.向NaHCO3溶液中加适量水
D.向NaHCO3溶液中加适量NaOH固体
(4)向NaClO溶液中通入少量CO2,所发生反应的离子方程式为:__________________________。
(5)常温下,计算NH4Cl溶液中,![]() 的水解常数Kh=_________________。
的水解常数Kh=_________________。