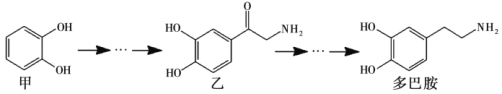
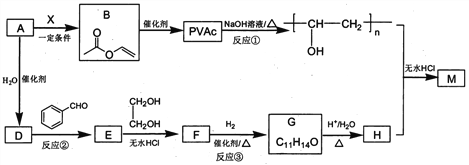
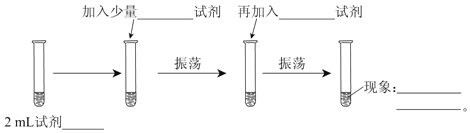
��Ŀ����
����Ŀ��������Ԫ��X��Y��Z��W��R��T�����ڱ��е�λ����ͼ��ʾ���밴Ҫ��ش��������⡣
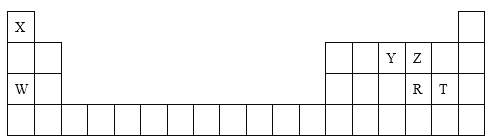
(1)R��W�γɻ�����ĵ���ʽΪ________________________��
(2)Y���⻯����T���⻯�ﷴӦ���������к��еĻ�ѧ��Ϊ_________��
(3)X��Z�γɵĶ�Ԫ�������У�����������Ϊ18�ķ��ӵĻ�ѧʽΪ______��
(4)ʵ������ȡT���ʵ����ӷ���ʽΪ______________________________��
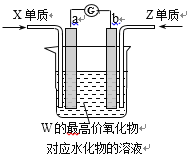
(5)��ͼ��a��bΪ���ʯī�缫(�缫�����뷴Ӧ)������W������������Ӧˮ�������Һ�У����˷ֱ�ͨ��X���ʺ�Z���ʣ����ֵ�����ָ�뷢��ƫת��
�ٵ�ع���ʱ�����ӵ��ƶ�����Ϊ��_____��_____(����a������b��)��
�ڸõ�ط�Ӧ���ﻷ������Ⱦ����õ�ص��ܷ�ӦʽΪ____________��
���𰸡�![]() ���Ӽ������ۼ� H2O2 MnO2+4H++2Cl��
���Ӽ������ۼ� H2O2 MnO2+4H++2Cl��![]() Mn2++Cl2����2H2O a b 2H2+O2=2H2O
Mn2++Cl2����2H2O a b 2H2+O2=2H2O
��������
����Ԫ�������ڱ���λ�ÿɵã�XΪHԪ�أ�YΪNԪ�أ�ZΪOԪ�أ�WΪNaԪ�أ�RΪSԪ�أ�TΪClԪ�أ��ݴ˷������
(1) RΪSԪ�أ�WΪNaԪ�أ�R��W�γɻ�����ΪNa2S������ʽΪ![]() ��
��
(2) YΪNԪ�أ�TΪClԪ�أ�Y���⻯����T���⻯��ֱ�ΪNH3��HCl����Ӧ��������ΪNH4Cl�����ں��й��ۼ������ӻ�������к��еĻ�ѧ��Ϊ���Ӽ������ۼ���
(3) XΪHԪ�أ�ZΪOԪ�أ�X��Z�γɵĶ�Ԫ������ΪH2O��H2O2������������Ϊ18�ķ��ӵĻ�ѧʽΪH2O��
(4) TΪClԪ�أ�ʵ�����ö������̺�Ũ�����ڼ��ȵ���������ȡ�����������ӷ���ʽΪMnO2+4H++2Cl��![]() Mn2++Cl2����2H2O��
Mn2++Cl2����2H2O��
(5) WΪNaԪ�أ�W������������Ӧˮ�������ҺΪ����������Һ�����˷ֱ�ͨ��H2��O2�����ֵ�����ָ�뷢��ƫת��˵����װ�ù�������ȼ�ϵ�ء�
�ٵ�ع���ʱ��ͨ��ȼ�ϵ�һ��Ϊ����������ͼ��ʾ��aΪ������bΪ�����������������������������a��b��
��װ�ù�������ȼ�ϵ�أ���ط�Ӧ����ֻ��ˮ����������Ⱦ����õ�ص��ܷ�ӦʽΪ2H2+O2=2H2O��

����Ŀ����������������Ҫ�ľ�ϸ�����Լ�������������ˮ����ʳ���㾫��ʵ�����Ʊ��������£�
�Լ�����������±���
������ | �Ҵ� | ���������� | |
������ɫ״̬ | ��ɫ��״���� | ��ɫҺ�� | ��ɫ��Һ�� |
�е�/�� | 249.0 | 78.0 | 212.6 |
��Է����� | 122 | 46 | 150 |
�ܽ��� | ����ˮ���������Ҵ������ѵ��л��ܼ� | ��ˮ����Ȼ��� | ��������ˮ��������ˮ���������Ҵ������� |
�ش��������⣺
��Ϊ���ԭ�ϱ�����Ĵ��ȣ��ɲ��õĴ�������Ϊ________��
�Ʋ���ٵ�װ����ͼ��ʾ�����Ⱥͼг�װ������ȥ������һС������������B�п��������״�������ˮ������ˮ����ͭ���Ҵ�������Һ����������B�У�������C�м���12.2g������ı����ᾧ�壬30mL��ˮ�Ҵ���Լ0.5mol����3mLŨ���ᣬ�����ʯ���������У�������Ӧ1.5��2h������A��������________________������C�з�ӦҺӦ����________��ʽ���ȡ�

�����ŷ�Ӧ���У���Ӧ��ϵ��ˮ�ֲ��ϱ���Ч���룬����B����ˮ��������Ϊ________��
�ȷ�Ӧ������C�л��Һ���з����ᴿ����������____�����������õIJ������������ձ����_____��
������Һ3�м�����Լ�XΪ________����д��ѧʽ����
�����յõ����﴿Ʒ12.0g��ʵ�����Ϊ________%��������λ��Ч���֣���
����Ŀ��NiCl2�ǻ����ϳ�������Ҫ����Դ����ʵ������ģ�ҵ���Խ���������(��Fe��Al������)Ϊԭ������NiCl2�Ĺ����������£�
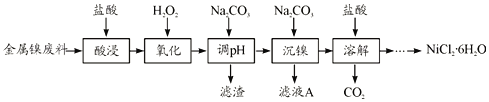
�±��г�����ؽ������������������������pH
�������� | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
��ʼ������pH | 2.1 | 6.5 | 3.7 | 7.1 |
������ȫ��pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)Ϊ�������Ԫ�صĽ����ʣ����������ʱ�ɲ�ȡ�Ĵ�ʩ��__________(дһ������)��
(2)����H2O2ʱ������Ҫ��Ӧ�����ӷ���ʽΪ__________��
(3)����pH��ʱ��������ҺpH�ķ�ΧΪ__________��
(4)�������������У�����ҺA��c(Ni2��)=1.0mol/L����ʹ100mL����Һ�е�Ni2��������ȫ�ۼ���Һ��c(Ni2��)��1.0��10-5�ݣ�������������ƽ��ȡNa2CO3�������������Ϊ_____g��(��֪Ksp(NiCO3)=6.5��10-6��������Һ����ı仯)
(5)����������Һ�õ�NiCl2��6H2O��ʵ�������������Ϊ______�����ˡ�ϴ�ӡ����