题目内容
【题目】二氧化硫的催化氧化原理为2SO2(g)+O2(g)![]() 2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
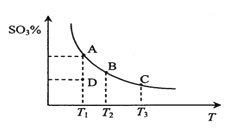
A. 反应2SO2(g)+O2(g)![]() 2SO3(g)的△H<0
2SO3(g)的△H<0
B. 在D点时v(正)<v(逆)
C. 若B、C点的平衡常数分别为KB、KC,则KB>KC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
【答案】B
【解析】
A.由图可知,升高温度,SO3的百分含量降低,说明升高温度平衡向逆反应移动,因此该反应正反应是放热反应,△H<0,故不选A;
B.曲线上的点都是平衡点,D点SO3的百分含量低于相同温度平衡点的含量,说明D点未到达平衡状态,反应正在向正反应进行,v(正)>v(逆)故选B;
C.升高温度,平衡向逆反应移动,故温度越高平衡常数越小,B点的温度低于C的温度,故平衡常数,KB>KC,故不选C;
D.恒温恒压下向平衡体系中通入氦气,体积增大(相当于减压),参与反应气体压强降低,平衡向体积增大的方向移动,即向平衡向左移动,故不选D;
答案:B

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。

(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。
【题目】X、Y、Z、M、Q、R 是 6 种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)元素 X 在元素周期表中的位置是_____
(2)元素 M 组成的单质的电子式为_____
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为_________________
(4)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是_____
(5)元素Q、元素 Z 的含量影响钢铁性能,若钢样中元素 Z 以 FeZ 的形式存在,高温下在过量空气中反应生成ZO2和一种红棕色的氧化物,则反应的化学方程式是_____