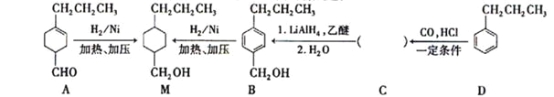
题目内容
【题目】如图所示是实验室制取乙烯的发生装置和验证乙烯性质的实验装置,反应原理为 CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
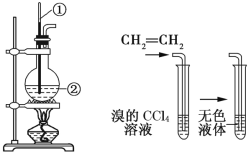
图1 图2
回答下列问题:
(1)图1中仪器①、②的名称分别为_______、_______。
(2)收集乙烯气体最好的方法是__________________。
(3)向溴的CCl4溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于_______(填反应类型),发生反应的化学方程式为_______________________________。
【答案】温度计圆底烧瓶排水集气法加成反应CH2=CH2+Br2![]() CH2BrCH2Br
CH2BrCH2Br
【解析】
(1)根据仪器的构造特点和反应的条件作答。
(2)乙烯的密度比空气略小,乙烯难溶于水且与水不反应,收集乙烯最好用排水集气法。
(3)乙烯与溴的CCl4溶液发生加成反应。
(1)制取乙烯的反应原理为CH3CH2OH![]() CH2=CH2↑+H2O,反应温度控制为170℃,仪器①的名称为温度计,根据反应原理和仪器的构造特点,仪器②的名称为圆底烧瓶。
CH2=CH2↑+H2O,反应温度控制为170℃,仪器①的名称为温度计,根据反应原理和仪器的构造特点,仪器②的名称为圆底烧瓶。
(2)乙烯的相对分子质量为28,比空气的平均相对分子质量(29)略小,乙烯的密度比空气略小,用排空气法难以收集到较纯净的乙烯;乙烯难溶于水且与水不反应,收集乙烯最好用排水集气法。
(3)向溴的CCl4溶液中通入乙烯,溶液的颜色很快褪去,因为乙烯与Br2发生了加成反应生成了无色的BrCH2CH2Br,反应的化学方程式为CH2=CH2+Br2→BrCH2CH2Br。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成.医疗消毒等领域。
回答下列问题:
(1)已知:H2(g)+![]() O2(g)=H2O(l) △H1=-286 kJ·mol1
O2(g)=H2O(l) △H1=-286 kJ·mol1
H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=______kJ·mol1。不同温度下过氧化氢分解反应的平衡常数K(313K)_____K(298K) (填大于、小于或等于)。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:
离子 | 加入量(mg·L1) | 分解率% | 离子 | 加入量(mg·L1) | 分解率% |
无 | 0 | 2 | Fe3+ | 1.0 | 15 |
Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧化氢时,可选用的容器材质为_________(填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
(3)过氧化氢的Ka1=2.24×1012,H2O2的酸性________H2O (填大于、小于或等于)。
研究表明,过氧化氢溶液中HO2-的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是___________________:相同pH下,过氧化氢浓度越大分解率越低的原因是__________________________________________。

【题目】下列实验操作对应的实验现象及解释或结论都正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色 | 氧化性:H2O2>Fe3+ |
B | 向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液 | 先产生白色沉淀,然后产生蓝色沉淀 | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 2NO2(g) |
D | 向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH) | 溶液紫色褪去 | 乙二醇被氧化为乙二酸 |
A. A B. B C. C D. D