题目内容
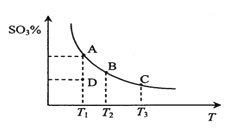
【题目】ZnSO4 受热分解过程中各物质物质的量随温度变化关系如图所示(A、B为含硫的氧化物),下列说法正确的是( )

A.ZnO 属于金属晶体
B.SO3 和 SO2 互为同素异形体
C.物质 A、B 分别是 SO3、SO2
D.700℃~980℃时发生反应的化学方程式为:2ZnSO4![]() 2ZnO+2SO2↑+O2↑
2ZnO+2SO2↑+O2↑
【答案】D
【解析】
A.ZnO 属于离子晶体,A不正确;
B.SO3 和 SO2 是化合物,而同素异形体是同种元素不同单质的互称,B不正确;
C.由图中可以看出,A为SO2、B为SO3,C不正确;
D.700℃~980℃时,SO2、O2同时生成,且满足n(ZnO):n(SO2):n(O2)=2:2:1,所以发生反应的化学方程式为:2ZnSO4![]() 2ZnO+2SO2↑+O2↑,D正确;
2ZnO+2SO2↑+O2↑,D正确;
故选D。

【题目】300℃时,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g) +Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=_____________
(2)能判断该反应已经达到平衡状态的是_____________
A.生成X的速率是生成Z的速率的2倍
B.容器内压强保持不变
C.容器内气体的密度保持不变
D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是_____________(任写一种)。
(4)温度为300℃时,该反应的化学平衡常数K=_______________
(5)若起始时向该容器中充入X、Y、Z各0.20 mol,则反应将向____(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数与上述平衡相比______(填“增大”、“减小”或“不变”)
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2molL-1盐酸 | 产生黄绿色气体 |
② | 0.2molL-1KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2molL-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2molL-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A.实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B.实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C.实验③中该条件下氧化性强弱:ClO->Fe3+
D.实验④中ClO-与Al3+相互促进水解