题目内容
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为___________________________。
(2)元素C与元素D以原子个数比为1∶1形成化合物Q,请写出Q的电子式为_______。
(3)用电子式表示化合物D2C的形成过程_____________________。
(4)元素A、B、C以原子个数比为4∶2∶3形成化合物W,化合物W中存在的化学键有____________________。
(5)写出碳单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式为____________,当转移电子为0.2 mol时,标准状况下反应产生气体_______________L。
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_____________。
【答案】第二周期第ⅤA族 ![]()
![]() 离子键 共价键 C+2H2SO4(浓)
离子键 共价键 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 3.36 S+3Cl2+4H2O=8H++6Cl-+SO42-
CO2↑+2SO2↑+2H2O 3.36 S+3Cl2+4H2O=8H++6Cl-+SO42-
【解析】
A、B、C、D、E、F是核电荷数依次增大的6种短周期主族元素,A元素的原子核内只有1个质子,则A为H元素;B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于元素周期表第ⅤA族,B元素的原子半径是其所在主族中最小的,则B为N元素;C元素原子的最外层电子数比次外层多4个,则B原子核外电子排布为2、6,原子最外层电子数为6,C为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,D为Na元素;C、E主族,则E为S元素,F的原子序数大于S,则F为Cl元素,据此进行解答。
根据上述分析可知:A是H,B是N,C是O,D是Na,E是S,F是Cl元素。
(1)B是N元素,原子核外电子排布为2、5,位于元素周期表第二周期第VA族;
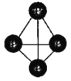
(2)元素C是O,D是Na,二者按原子个数比为1∶1形成化合物Q为Na2O2,该物质为离子化合物,2个Na+与O22-之间通过离子键结合,O22-中2个O原子之间以共价键结合,其电子式为:![]() ;
;
(3)化合物D2C是Na2O,该化合物为离子化合物,用电子式表示其形成过程为:![]() ;
;
(4)元素A、B、C以原子个数比为4∶2∶3形成化合物W是NH4NO3,该化合物是离子化合物,NH4+与NO3-之间通过离子键结合,在NH4+与NO3-内都含有极性共价键,因此NH4NO3中含有的化学键类型为离子键、共价键;
(5)E是S元素,其最高价氧化物对应的水化物是H2SO4,C与浓硫酸在加热时发生氧化还原反应产生CO2、SO2、H2O,反应的化学方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。根据方程式可知:每转移4 mol电子,反应产生1 mol CO2和2 mol SO2气体,共3 mol气体,则反应转移0.2 mol电子时,产生气体的物质的量为
CO2↑+2SO2↑+2H2O。根据方程式可知:每转移4 mol电子,反应产生1 mol CO2和2 mol SO2气体,共3 mol气体,则反应转移0.2 mol电子时,产生气体的物质的量为![]() ×0.2 mol=0.15 mol,气体在标准状况下的体积V=0.15 mol×22.4 L/mol=3.36 L;
×0.2 mol=0.15 mol,气体在标准状况下的体积V=0.15 mol×22.4 L/mol=3.36 L;
(6)E是S元素,F是Cl元素,二者的单质在水溶液中反应产生两种强酸分别是H2SO4、HCl,根据原子守恒及电子守恒、电荷守恒,可得该反应的离子方程式为:S+3Cl2+4H2O=8H++6Cl-+SO42-。

【题目】PH3是粮食杀虫处理时常用的熏蒸杀虫剂;水煤气变换时产生的PH3能使催化剂中毒,必须脱除。回答下列问题:
(1)PH3通入NaClO溶液脱除PH3时,氧化产物是一种含氧酸且反应中氧化剂与还原剂的物质的量之比为4:1,则该含氧酸的化学式为______。
(2)已知下列键能数据及P4(白磷)分子结构:
化学键 | P-P | H-H | P-H |
|
键能/(kJmol-1) | 213 | 436 | 322 |
则反应4PH3(g)P4(g)+6H2(g)△H=______kJmol-1;某温度时平衡体系中c(PH3)=0.25molL-1,c(H2)=c(P4)=0.50molL-1,则平衡常数K=______。
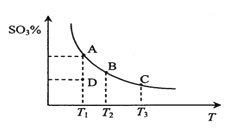
(3)文献报道“反应6.25CO2(g)+Fe3O4(s)+3PH3(g)=3FePO4(s)+4.5H2O(g)+6.25C(s)”是铁触媒中毒的主导反应,其平衡常数Kp(Kp为以分压表示的平衡常数)的对数值与温度的关系如图所示:
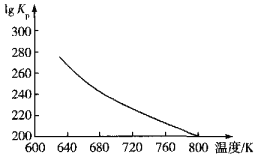
①该反应的△H______0(填“>”“<”或“=”)。
②图中lgKp=______[列出用分压p(CO2)、p(PH3)、p(H2O)表示的计算式]。
(4)反应(CH3)3AuPH3→(CH3)AuPH3+C2H6的历程如下:
第一步:(CH3)3AuPH3![]() (CH3)3Au+PH3(快反应)
(CH3)3Au+PH3(快反应)
第二步:(CH3)3Au![]() C2H6+CH3Au(慢反应)
C2H6+CH3Au(慢反应)
第三步:CH3Au+PH3![]() (CH3)AuPH3(快反应)
(CH3)AuPH3(快反应)
①反应的中间产物有PH3、______。
②第______步(填“一”“二”或“三”)反应的活化能最大。
(5)用Cu2+、Pd2+液相脱除PH3的反应为:PH3+2O2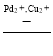 H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
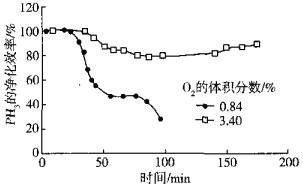
O2的体积分数大,PH3的净化效率高的原因是______(用碰撞理论等说明)。