题目内容
5.N2O3是硝酸的酸酐,在一定条件下可由4NO2(g)+O2(g)?2N2O3(g)△H<0合成.T1℃时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如下表:| 时间/s | 0 | 5 | 10 | 15 |
| c(NO2)mol/L | 4.00 | 2.52 | 2.00 | c3 |
| c(O2)mol/L | 1.00 | c1 | c2 | 0.50 |
| A. | 5s内O2的反应速率为0.074mol/L•s) | |
| B. | T1℃时平衡常数为0.125,平衡时NO2和O2的转化率均为50% | |
| C. | T1℃时平衡常数为K1,T2℃时平衡常数为K2,若T1>T2,则K1<K2 | |
| D. | 其它条件不变,将容器的体积的压缩到原来的一半,则重新达到平衡时c(N2O3)<2mol/L |
分析 A.根据v=$\frac{△c}{△t}$计算5s内NO2表示的速率,再利用速率之比等于化学计量数之比计算v(O2);
B.10s时NO2的浓度变化量为4mol/L-2mol/L=2mol/L,则此时氧气浓度变化量为$\frac{1}{4}$×2mol/L=0.5mol/L,此时氧气浓度为1mol/L-0.5mol/L=0.5mol/L,与15s时氧气的浓度相等,故10s时反应到达平衡,再计算平衡时N2O3的浓度,代入平衡常数表达式K=$\frac{{c}^{2}({N}_{2}{O}_{3})}{{c}^{4}(N{O}_{2})×c({O}_{2})}$计算,反应物转化率=$\frac{浓度变化量}{起始浓度}$×100%;
C.平衡常数只受温度影响,该反应正反应是放热反应,升高温度,平衡向逆反应移动,化学平衡常数减小;
D.根据B可知原平衡时N2O3的浓度,到平衡后其它条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,压强增大一倍,平衡向正反应方向移动.
解答 解:A.5s内NO2的浓度变化量为4mol/L-2.52mol/L=1.48mol/L,故v(NO2)=$\frac{1.48mol/L}{5s}$=0.296mol/(L•s),速率之比等于化学计量数之比,则v(O2)=$\frac{1}{4}$v(NO2)=$\frac{1}{4}$×0.296mol/(L•s)=0.074mol/L•s),故A正确;
B.10s时NO2的浓度变化量为4mol/L-2mol/L=2mol/L,则此时氧气浓度变化量为$\frac{1}{4}$×2mol/L=0.5mol/L,此时氧气浓度为1mol/L-0.5mol/L=0.5mol/L,与15s时氧气的浓度相等,故10s时反应到达平衡,平衡时N2O3的浓度为2×0.5mol/L=1mol/L,则该温度下平衡常数K=$\frac{{c}^{2}({N}_{2}{O}_{3})}{{c}^{4}(N{O}_{2})×c({O}_{2})}$=$\frac{{1}^{2}}{{2}^{4}×0.5}$=0.125,平衡时NO2的转化率均为$\frac{2mol/L}{4mol/L}$×100%=50%、O2的转化率均为$\frac{0.5mol/L}{1mol/L}$×100%=50%,故B正确;
C.平衡常数只受温度影响,该反应正反应是放热反应,升高温度,平衡向逆反应移动,平衡常数减小,若温度T1>T2,则平衡常数K1<K2,故C正确;
D.由B中计算可知原平衡时c(N2O3)=1mol/L,达到平衡后其他条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,若平衡不移动,则c(N2O3)=2mol/L,但压强增大一倍,平衡向正反应方向移动,则c(N2O5)>2mol/L,故D错误,
故选D.
点评 本题考查化学反应速率计算、化学平衡影响因素、化学平衡平衡常数计算及影响因素等,难度中等,注意理解掌握外界条件对平衡移动的影响.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 糖类不一定都是高分子化合物,但水解产物相同 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,证明甲苯分子中存在单双键交替的结构 | |
| C. | 利用粮食酿酒经过了由淀粉→葡萄糖→乙醇的化学变化过程 | |
| D. | 甲醇、乙二醇(HOCH2CH2OH)互为同系物 |
| A. | 向NaAlO2溶液中通入足量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | (NH4)2Fe(SO4)2溶液中加入少量氢氧化钡溶液:NH4++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 工业上用氨水吸收二氧化硫:2NH3.H2O+SO2═2NH4++SO32- | |
| D. | 磁性氧化铁溶于稀硝酸3Fe2++4H++NO3-═3Fe3++NO↑+2H2 |
| A. | Mg 2++2HC03-+Ca 2++2OH -→MgC03↓+CaC03↓+2H20 | |
| B. | Mg 2++2HC03-+2Ca 2++4OH -→Mg(OH)2↓+2CaC03↓+2H20 | |
| C. | Mg 2++3HC03-+3Ca 2++5OH -→Mg(OH)2↓+3CaC03↓+3H20 | |
| D. | Ca2++C032-→CaCO3↓ |
| A. | HBr、KOH、CaCO3、H2O都是强电解质 | |
| B. | Na2O2、CaO、Al2O3都是碱性化合物,SiO2、SO2、NO2都是酸性氧化物 | |
| C. | 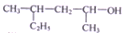 的名称为4-甲基-2-己醇 的名称为4-甲基-2-己醇 | |
| D. | ${\;}_{94}^{218}$Pu的质子数为94,中子数为238,电子数为144 |
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH2COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| A. | 直径为20nm的纳米碳酸钙属于胶体 | |
| B. | 海水中提取镁的各步均为氧化还原反应 | |
| C. | 可溶性铁盐和铝盐可用作净水剂 | |
| D. | 光导纤维是一种新型硅酸盐材料 |