题目内容
15.在一体积固定的密闭容器中加入反应物A,B,发生如下反应:A+2B=3C.反应经2min后,A的浓度从开始时的1.0mol/L降到0.8mol/L.已知反应开始时B的浓度是1.2mol/L,求:( 1)2min末B,C的浓度.
( 2)以单位时间内A的浓度的减小来表示2min内该反应的平均速率.
分析 依据化学方程式结合三段式列式计算,
A+2B=3C
起始量(mo/L) 1.0 1.2 0
变化量(mol/L) 0.2 0.4 0.6
2min后(mol/L) 0.8 0.8 0.6
再根据反应速率V=$\frac{△c}{△t}$进行计算.
解答 解:A+2B=3C
起始量(mo/L) 1.0 1.2 0
变化量(mol/L) 0.2 0.4 0.6
2min后(mol/L) 0.8 0.8 0.6
(1)2min末B的浓度为0.8mol/L、C的浓度为0.6mol/L;
故答案为:B的浓度为0.8mol/L、C的浓度为0.6mol/L;
(2)以单位时间内A的浓度的减小来表示2min内该反应的平均速率=$\frac{0.2mol/L}{2min}$=0.1mol/L•min;
故答案为:以单位时间内A的浓度的减小来表示2min内该反应的平均速率为0.1mol/L•min.
点评 本题考查化学反应速率的相关计算,难度不大.要注意平衡三段式的应用.

练习册系列答案
相关题目
5.N2O3是硝酸的酸酐,在一定条件下可由4NO2(g)+O2(g)?2N2O3(g)△H<0合成.T1℃时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如下表:
下列说法不正确的是( )
| 时间/s | 0 | 5 | 10 | 15 |
| c(NO2)mol/L | 4.00 | 2.52 | 2.00 | c3 |
| c(O2)mol/L | 1.00 | c1 | c2 | 0.50 |
| A. | 5s内O2的反应速率为0.074mol/L•s) | |
| B. | T1℃时平衡常数为0.125,平衡时NO2和O2的转化率均为50% | |
| C. | T1℃时平衡常数为K1,T2℃时平衡常数为K2,若T1>T2,则K1<K2 | |
| D. | 其它条件不变,将容器的体积的压缩到原来的一半,则重新达到平衡时c(N2O3)<2mol/L |
6.下列关于AlCl3的说法中正确的是( )
| A. | AlCl3溶液中还可能大量存在:H+、NH4+、SO42-、NO3- | |
| B. | AlCl3溶液与过量的氨水反应的离子方程式为:Al3++4NH3•H2O═4NH4++AlO2-+2H2O | |
| C. | 若NA为阿伏伽德罗常数的值,则1L0.1mol•L-1的AlCl3溶液中Al3+的数目为0.1NA | |
| D. | 工业上可用电解熔融的AlCl3来制取金属Al |
10.-种新型试剂常用于氧化降解溶液中的有机污染物(用X表 示),在一定条件下反应开始时其浓度为2.0×10-3mol•L-1,反应10 min后进行测定,测得数据如图1、图2所示,则下列有关说法正确的是( )


| A. | pH=2、温度为50℃、10 min时,X的物质的量浓度c( X)为5.6×10-4mol•L-1 | |
| B. | 图2说明:任何条件下X降解率均随温度升高先增后减 | |
| C. | 无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃ | |
| D. | 图1说明:50℃时,X的降解率随溶液PH的增大而逐渐减小 |
12.月球土壤中含有较丰富的${\;}_{2}^{3}$He,在地球上氦元素主要以${\;}_{2}^{4}$He的形式存在,下列说法正确的是( )
| A. | ${\;}_{2}^{3}$He代表原子核内有2个质子和3个中子的氦原子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He分别含有1和2个质子 | |
| C. | ${\;}_{2}^{3}$He 和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{3}$He的最外层电子数为1,所以${\;}_{2}^{3}$He 具有较强的金属性 |
9.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
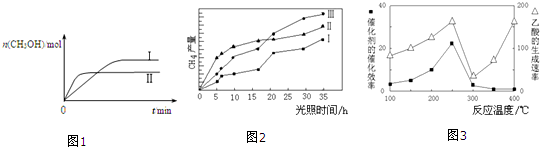
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化如图1.
①该反应的△H小于0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为0.4<b≤1.
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素.
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.

(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化如图1.
①该反应的△H小于0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素.
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
10.加入稀盐酸后,溶液中下列离子数目不减少的是( )
| A. | CO32- | B. | SO42- | C. | Ag+ | D. | SO32- |
