题目内容
20.下列说法正确的是( )| A. | HBr、KOH、CaCO3、H2O都是强电解质 | |
| B. | Na2O2、CaO、Al2O3都是碱性化合物,SiO2、SO2、NO2都是酸性氧化物 | |
| C. | 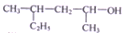 的名称为4-甲基-2-己醇 的名称为4-甲基-2-己醇 | |
| D. | ${\;}_{94}^{218}$Pu的质子数为94,中子数为238,电子数为144 |
分析 A、强电解质一般是强酸、强碱和活泼金属氧化物以及大部分盐;
B、酸性氧化物是能与碱反应生成盐和水的氧化物,碱性氧化物是能与水反应生成碱的氧化物;
C、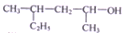 中主链含6个C,-OH在2号碳上,甲基在4号C上;
中主链含6个C,-OH在2号碳上,甲基在4号C上;
D、质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A、水是弱电解质,故A错误;
B、Na2O2不是碱性氧化物,不是NO2不是酸性氧化物,Al2O3是两性氧化物,故B错误;
C、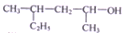 正确命名为:4-甲基-2-己醇,故C正确;
正确命名为:4-甲基-2-己醇,故C正确;
D、原子中电子数等于质子数,即电子数也是94,故D错误,
故选C.
点评 本题主要考查的是强弱电解质的概念、酸性氧化物与碱性氧化物的概念、有机物的命名、核素的含义等,综合性较强,但是难度不大.

练习册系列答案
相关题目
5.N2O3是硝酸的酸酐,在一定条件下可由4NO2(g)+O2(g)?2N2O3(g)△H<0合成.T1℃时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如下表:
下列说法不正确的是( )
| 时间/s | 0 | 5 | 10 | 15 |
| c(NO2)mol/L | 4.00 | 2.52 | 2.00 | c3 |
| c(O2)mol/L | 1.00 | c1 | c2 | 0.50 |
| A. | 5s内O2的反应速率为0.074mol/L•s) | |
| B. | T1℃时平衡常数为0.125,平衡时NO2和O2的转化率均为50% | |
| C. | T1℃时平衡常数为K1,T2℃时平衡常数为K2,若T1>T2,则K1<K2 | |
| D. | 其它条件不变,将容器的体积的压缩到原来的一半,则重新达到平衡时c(N2O3)<2mol/L |
12.在实验室里,下列除去杂质的方法正确的是 ( )
| A. | 溴苯中混有溴,加入KI溶液,用汽油萃取出溴 | |
| B. | 乙烷中混有乙烯,在一定条件下反应通入氢气,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓硝酸和浓硫酸,将其倒入浓烧碱溶液中,静置,然后分液 | |
| D. | 乙烷中混有CO2,将其通入碳酸氢钠溶液洗气后干燥 |
9.25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示.下列说法正确的是( )
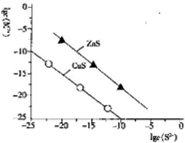

| A. | Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃时K甲(CuS)均为1×10-28 | |
| C. | 向l00mLZn2+、Cu2+均为10-5mol•L-1 的混合溶液中逐滴加入10-4mol•L-1 Na2S溶液,Zn2+先沉淀 | |
| D. | 向Cu2+浓度为10-5mol•L-1工业废水中加入ZnS粉末,会有CuS沉淀析出 |
10.-种新型试剂常用于氧化降解溶液中的有机污染物(用X表 示),在一定条件下反应开始时其浓度为2.0×10-3mol•L-1,反应10 min后进行测定,测得数据如图1、图2所示,则下列有关说法正确的是( )


| A. | pH=2、温度为50℃、10 min时,X的物质的量浓度c( X)为5.6×10-4mol•L-1 | |
| B. | 图2说明:任何条件下X降解率均随温度升高先增后减 | |
| C. | 无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃ | |
| D. | 图1说明:50℃时,X的降解率随溶液PH的增大而逐渐减小 |
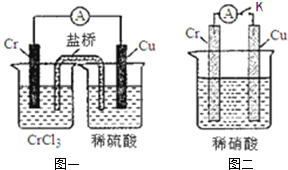 在如图装置中,观察到图一装置铜电极上产生大量的无色气泡.而在图二装置中当开关K断开时,铬电极无现象,K闭合时,铬电极上产生大量无色气体,并变成红棕色气体.
在如图装置中,观察到图一装置铜电极上产生大量的无色气泡.而在图二装置中当开关K断开时,铬电极无现象,K闭合时,铬电极上产生大量无色气体,并变成红棕色气体.
 ;由F生成一硝化产物的化学方程式为:
;由F生成一硝化产物的化学方程式为: +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O,芳香化合物F的名称是对苯二甲酸.
+H2O,芳香化合物F的名称是对苯二甲酸.