题目内容
13.某水体溶有Ca2+、Mg2+、HCO3-三种离子,可先加足量消石灰,再加足量纯碱以除去Ca2+、Mg2+,以下离子方程式肯定不符合反应事实的是( )| A. | Mg 2++2HC03-+Ca 2++2OH -→MgC03↓+CaC03↓+2H20 | |
| B. | Mg 2++2HC03-+2Ca 2++4OH -→Mg(OH)2↓+2CaC03↓+2H20 | |
| C. | Mg 2++3HC03-+3Ca 2++5OH -→Mg(OH)2↓+3CaC03↓+3H20 | |
| D. | Ca2++C032-→CaCO3↓ |
分析 Ca 2+、Mg 2+、HCO3-三种离子,可先加足量消石灰,镁离子反应生成氢氧化镁沉淀,碳酸氢根离子与氢氧根离子反应生成碳酸根离子,碳酸根与钙离子反应生成碳酸钙沉淀,再加足量纯碱碳酸根离子与钙离子反应生成碳酸钙沉淀,据此分析解答.
解答 解:Ca 2+、Mg 2+、HCO3-三种离子,可先加足量消石灰,镁离子反应生成氢氧化镁沉淀,离子方程式:Mg 2++2OH-=Mg(OH)2↓,碳酸氢根离子与氢氧根离子反应生成碳酸根离子,2HC03-+OH-=C032-,碳酸根与钙离子反应生成碳酸钙沉淀,离子方程式:Ca2++C032-→CaCO3↓,再加足量纯碱碳酸根离子与钙离子反应生成碳酸钙沉淀,离子方程式:Ca2++C032-→CaCO3↓,
A.氢氧化镁溶解度小于碳酸镁溶解度,消石灰过量,所以溶液中的镁离子全部转化为氢氧化镁沉淀,不可能生成碳酸镁,最后反应得到的物质为氢氧化镁、碳酸钙和水,正确离子方程式:Mg2++3HCO3-+3Ca2++5OH-→Mg(OH)2↓+3CaCO3↓+3H2O,故A错误;
B.原溶液中含有钙离子,则碳酸氢根离子的系数错误,不满足溶液电中性,当镁离子与钙离子物质的量相等时,发生反应为:Mg2++3HCO3-+3Ca2++5OH-→Mg(OH)2↓+3CaCO3↓+3H2O,故B错误;
C.镁离子、碳酸氢根离子与足量氢氧化钙反应生成,当镁离子与钙离子的物质的量相等时发生该反应离子方程式:Mg 2++3HC03-+3Ca 2++5OH -→Mg(OH)2↓+3CaC03↓+3H20,故C正确;
D.碳酸根与钙离子反应生成碳酸钙沉淀,反应离子方程式:Ca2++CO32-→CaCO3↓,故D正确;
故选:AB.
点评 本题考查了离子反应,明确常见离子的性质是解题关键,注意氢氧化镁与碳酸镁沉淀溶解度大小关系,题目难度中等.

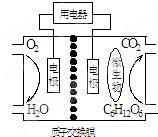
| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ | |
| C. | 放电过程中,H+从正极区向负极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下气体$\frac{2.42}{6}$L |
| 时间/s | 0 | 5 | 10 | 15 |
| c(NO2)mol/L | 4.00 | 2.52 | 2.00 | c3 |
| c(O2)mol/L | 1.00 | c1 | c2 | 0.50 |
| A. | 5s内O2的反应速率为0.074mol/L•s) | |
| B. | T1℃时平衡常数为0.125,平衡时NO2和O2的转化率均为50% | |
| C. | T1℃时平衡常数为K1,T2℃时平衡常数为K2,若T1>T2,则K1<K2 | |
| D. | 其它条件不变,将容器的体积的压缩到原来的一半,则重新达到平衡时c(N2O3)<2mol/L |
| A. | 用四氯化碳可以萃取乙酸水溶液中的乙酸 | |
| B. | 丁烷有两种同分异构体 | |
| C. | 乙烯可以与氢气发生加成反应,也可发生自身加聚反应生成聚乙烯 | |
| D. | 纤维素、淀粉和蛋白质都是高分子化合物 |

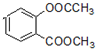 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.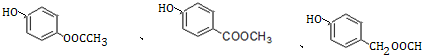 (写出其中一种的结构简式).
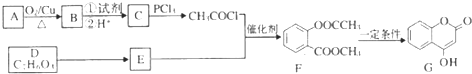
(写出其中一种的结构简式).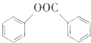 )是一种重要的有机合成中间体,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)
)是一种重要的有机合成中间体,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)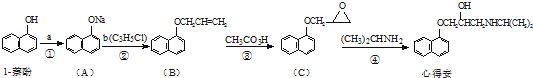
 ;由F生成一硝化产物的化学方程式为:
;由F生成一硝化产物的化学方程式为: +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O,芳香化合物F的名称是对苯二甲酸.
+H2O,芳香化合物F的名称是对苯二甲酸.