题目内容
10.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH2COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
分析 A.碳酸氢钠溶液中,碳酸氢根离子的水解程度大于其电离程度,则溶液中c(H2CO3)>c(CO32-);
B.根据碳酸钠溶液中的质子守恒判断;
C.反应后的溶质为等物质的量的碳酸钠、碳酸氢钠,碳酸根离子的水解程度大于碳酸氢根离子,则溶液中碳酸氢根离子浓度大于碳酸根离子;
D.CH3COONa和CH3COOH混合溶液的pH=7,显示中性,据电荷守恒、溶液组成进行分析.
解答 解:A.碳酸氢钠溶液中,碳酸氢根离子的电离程度小于其水解程度,溶液显示碱性,则:c(H2CO3)>c(CO32-),溶液中正确的粒子难度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故A错误;
B.根据碳酸钠溶液中的质子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故B错误;
C.向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液,反应后溶质为等浓度的NaHCO3、Na2CO3,CO32-的水解程度大于HCO3-,则:c(HCO3-)>c(CO32-),溶液中正确的离子浓度关系为:c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.CH3COONa和CH3COOH混合溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(CH3COO-)=O.1mol/l,溶液中离子浓度大小为:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小比较、盐的水解原理及其应用等知识,题目难度中等,明确电荷守恒、物料守恒以及质子守恒的应用为解答关键,注意掌握盐的水解原理.

练习册系列答案
相关题目
20. 天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
H2S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{氧化}{→}$H2SO4
(1)物质发生不完全燃烧时的反应热难以通过实验测得.已知硫化氢气体的燃烧热是586kJ/mol,固体硫单质的燃烧热是297 kJ•mol-1.写出硫化氢气体不完全燃烧生成固体硫单质的热化学方程式H2S(g)+$\frac{1}{2}$O2(g)=S(s)+H2O (l)△H=-279kJ/mol.
(2)工业生产中硫化氢尾气可用NaOH溶液吸收.
①吸收尾气后得到的Na2S溶液显碱性(填“酸”、“碱”、“中”);
②下列与H2S、NaHS和Na2S相关的离子方程式正确的是(填字母序号)AC.
A.H2S+OH-=HS-+H2O
B.HS-+H2O=H2S+OH-
C.HS-+H2O?S2-+H3O+
D.S2-+H2O?H2S+2OH-
(3)在一定温度下,某容器中发生2H2S(g)?2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol•L-1)如下表,根据表中数据回答问题:
①判断90min时反应速率v(正)= v(逆)(填“>”、“=”或“<”);
②求该温度下反应的化学平衡常数(不必写出计算过程)K=0.0025 mol•L-1.
(4)以硫化氢为原料,使用质子固体电解质(能传导H+)构成燃料电池,硫化氢放电后生成硫蒸气(化学式S2),该燃料电池的负极反应式为2H2S-4e-=S2+4H+.
(5)硫酸是强酸,在图中画出硫酸溶液和氢氧化钠溶液反应过程的能量变化示意图.
 天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:H2S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{氧化}{→}$H2SO4
(1)物质发生不完全燃烧时的反应热难以通过实验测得.已知硫化氢气体的燃烧热是586kJ/mol,固体硫单质的燃烧热是297 kJ•mol-1.写出硫化氢气体不完全燃烧生成固体硫单质的热化学方程式H2S(g)+$\frac{1}{2}$O2(g)=S(s)+H2O (l)△H=-279kJ/mol.
(2)工业生产中硫化氢尾气可用NaOH溶液吸收.
①吸收尾气后得到的Na2S溶液显碱性(填“酸”、“碱”、“中”);
②下列与H2S、NaHS和Na2S相关的离子方程式正确的是(填字母序号)AC.
A.H2S+OH-=HS-+H2O
B.HS-+H2O=H2S+OH-
C.HS-+H2O?S2-+H3O+
D.S2-+H2O?H2S+2OH-
(3)在一定温度下,某容器中发生2H2S(g)?2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol•L-1)如下表,根据表中数据回答问题:
时间 物质 | 0min | 20min | 60min | 90min | 120min |
| H2S | 0.006 | 0.005 | |||
| H2 | 0 | 0.002 | 0.004 | ||
| S2 | 0 | 0.002 | 0.0025 |
②求该温度下反应的化学平衡常数(不必写出计算过程)K=0.0025 mol•L-1.
(4)以硫化氢为原料,使用质子固体电解质(能传导H+)构成燃料电池,硫化氢放电后生成硫蒸气(化学式S2),该燃料电池的负极反应式为2H2S-4e-=S2+4H+.
(5)硫酸是强酸,在图中画出硫酸溶液和氢氧化钠溶液反应过程的能量变化示意图.
5.N2O3是硝酸的酸酐,在一定条件下可由4NO2(g)+O2(g)?2N2O3(g)△H<0合成.T1℃时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如下表:
下列说法不正确的是( )
| 时间/s | 0 | 5 | 10 | 15 |
| c(NO2)mol/L | 4.00 | 2.52 | 2.00 | c3 |
| c(O2)mol/L | 1.00 | c1 | c2 | 0.50 |
| A. | 5s内O2的反应速率为0.074mol/L•s) | |
| B. | T1℃时平衡常数为0.125,平衡时NO2和O2的转化率均为50% | |
| C. | T1℃时平衡常数为K1,T2℃时平衡常数为K2,若T1>T2,则K1<K2 | |
| D. | 其它条件不变,将容器的体积的压缩到原来的一半,则重新达到平衡时c(N2O3)<2mol/L |
2.下列关于有机化合物的说法不正确的是( )
| A. | 用四氯化碳可以萃取乙酸水溶液中的乙酸 | |
| B. | 丁烷有两种同分异构体 | |
| C. | 乙烯可以与氢气发生加成反应,也可发生自身加聚反应生成聚乙烯 | |
| D. | 纤维素、淀粉和蛋白质都是高分子化合物 |
19.右图表示容积固定的密闭容器中进行的某一可逆反应,A(g)+2B(g)?2C(g),以B的浓度变化表示的反应速率与时间的关系,已知速率的单位为mol/(L•s)图中阴影部分的数值相当于( )
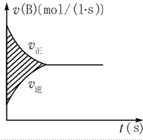

| A. | A浓度的减小量 | B. | B浓度的减小量 | ||
| C. | C物质的量的增加量 | D. | B物质的量的减少量 |
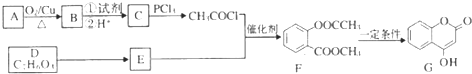

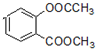 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+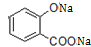 +H2O.
+H2O.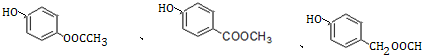 (写出其中一种的结构简式).
(写出其中一种的结构简式).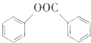 )是一种重要的有机合成中间体,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)
)是一种重要的有机合成中间体,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)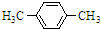 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$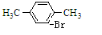 +HBr.
+HBr.