题目内容
【题目】近年来,我国对雾霾的治理重视有加。研究NO2、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,发生反应的离子方程式是__________________。
(2)在恒温恒容的容器中充入3molCO,3molH2发生反应2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是____________。
CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是____________。
A.CO和CH3OCH3(g)的生成速率相等
B.混合物中CO的体积分数保持不变
C.反应容器中的压强不再变化
D.反应容器内CO、H2、CH3OCH3(g)、H2O(g)四者共存
E.反应容器中混合气体的平均摩尔质量保持不变
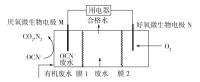
(3)利用反应6NO2+8NH3=7N2+12H2O设计为电池可消除NO2,其简易装置如图所示。
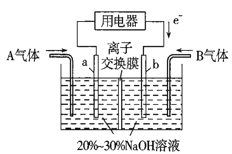
①b极的电极反应式为______________________。
②常温下,若用该电池电解0.6L饱和KCl溶液,一段时间后,测得饱和KCl溶液pH变为13,则理论上a极上消耗A气体的体积为_____mL(气体处于标准状况;假设电解过程中溶液体积不变)。
(4)化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:①2NO(g)=N2(g)+O2(g) H1= -177kJ.mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) H2= -1253.4kJ.mol-1
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(5)氨氧化物可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,则该反应的化学方程式为____________。已知常温下.Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(1)的平衡常数为________。
NaNO2(aq)+H2O(1)的平衡常数为________。
【答案】2OH-+SO2=SO32-+H2O BCE 2NO2+8e-+4H2O=N2+8OH- 448 4NH3(g)+6NO(g)=5N2(g)+6H2O(g) H=-1784.4kJ·mol-1 NO+NO2+2NaOH=2NaNO2+H2O 5×1010
【解析】
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,发生反应的离子方程式是2OH-+SO2=SO32-+H2O。
(2)A.CO和CH3OCH3(g)的生成速率相等不满足正逆反应速率相等,没有达到平衡状态,A错误;
B.混合物中CO的体积分数保持不变说明正逆反应速率相等,达到了平衡状态,B正确;
C.正反应体积减小,反应容器中的压强不再变化说明正逆反应速率相等,达到了平衡状态,C正确;
D.反应容器内CO、H2、CH3OCH3(g)、H2O(g)四者共存不能说明正逆反应速率相等,不一定达到平衡状态,D错误;
E.气体质量不变,物质的量减小,则反应容器中混合气体的平均摩尔质量保持不变说明正逆反应速率相等,达到了平衡状态,E正确;
答案选BCE。
(3)①b极电子流入,是正极,NO2得到电子,电极反应式为2NO2+8e-+4H2O=N2+8OH-。
②常温下,若用该电池电解0.6L饱和KCl溶液,一段时间后,测得饱和KCl溶液pH变为13,生成氢氧化钾是0.6L×0.1mol/L=0.06mol,转移0.06mol电子,a电极氨气放电,1mol氨气转移3mol电子,则理论上a极上消耗A气体的物质的量是0.02mol,体积为448mL。
(4)已知:①2NO(g)=N2(g)+O2(g)H1= -177kJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)H2= -1253.4kJ·mol-1
则根据盖斯定律可知①×3+②即得到NH3处理NO生成氮气和气态水的热化学方程式为4NH3(g)+6NO(g)=5N2(g)+6H2O(g) H=-1784.4kJ·mol-1。
(5)氨氧化物可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,该盐是亚硝酸钠,则该反应的化学方程式为NO+NO2+2NaOH=2NaNO2+H2O。已知常温下Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(1)的平衡常数为
NaNO2(aq)+H2O(1)的平衡常数为![]() =5×1010。
=5×1010。