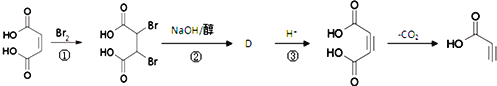
题目内容
【题目】随着科学的发展,可逐步合成很多重要的化工产品,如用作照相定影剂的硫代硫酸钠(俗称大苏打),用于填充汽车安全气囊的叠氮化钠(NaN3),某化学兴趣小组拟制备硫代硫酸钠晶体和NaN3。
I.制备硫代硫酸钠晶体。
查阅资料:Na2S2O3易溶于水,向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。实验装置如图所示(省略夹持装置):
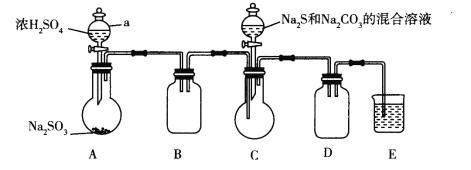
(1)组装好仪器后,接下来应该进行的实验操作是_____,然后加入试剂。仪器a的名称是_______;E中的试剂最好是__________.(填标号),作用是______________。
A.澄清石灰水B.NaOH溶液 C.饱和NaHSO3溶液
(2)已知五水合硫代硫酸钠的溶解度随温度升高显著增大。待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经_________(填操作名称)、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有______________。
Ⅱ.实验室利用如图装置(省略夹持装置)模拟工业级NaN3的制备。已知:2NaNH2+N2O![]() NaN3+NaOH+NH3。
NaN3+NaOH+NH3。
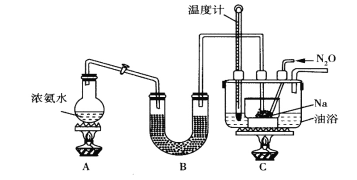
(1)装置B中盛放的药品为__________
(2)实验中使用油浴而不用水浴的原因是__________________________。
(3)氨气与熔融的钠反应生成NaNH2的化学方程式为_________________。
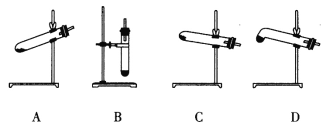
(4)N2O可由NH4NO3(熔点为169.6oC)在240oC下分解制得,应选择的气体发生装置是___________。
【答案】检查装置气密性 分液漏斗 B 吸收多余的SO2和C装置中生成的CO2气体 蒸发浓缩,冷却结晶 玻璃棒、烧杯、漏斗 碱石灰 制备NaN3的反应需要在210-220oC下进行,水浴不能达到这样的温度 2Na+2NH3=2NaNH2+H2 D
【解析】
I.(1)组装好仪器后,接下来应该进行的实验操作是检查装置气密性,然后加入试剂。仪器a的名称是分液漏斗。二氧化硫有毒,需要尾气处理,且反应中还有二氧化碳生成,澄清石灰水浓度太低,则E中的试剂最好是氢氧化钠溶液,作用是吸收多余的SO2和C装置中生成的CO2气体。
(2)由于五水合硫代硫酸钠的溶解度随温度升高显著增大。待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经蒸发浓缩,冷却结晶、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有玻璃棒、烧杯、漏斗。
Ⅱ.(1)生成的氨气中含有水蒸气,需要干燥,则装置B中盛放的药品为碱石灰。
(2)由于制备NaN3的反应需要在210~220oC下进行,水浴不能达到这样的温度,所以实验中使用油浴而不用水浴。
(3)氨气与熔融的钠反应生成NaNH2,根据原子守恒可知还有氢气生成,反应的化学方程式为2Na+2NH3=2NaNH2+H2。
(4)N2O可由NH4NO3(熔点为169.6oC)在240oC下分解制得,由于在该温度下硝酸铵已熔化,同时为避免液体倒流引起试管炸裂,因此选择的气体发生装置是装置D。