题目内容
10.由10g含有杂质的CaCO3和足量盐酸反应,产生了0.1mol CO2,推断杂质的组成不可能是( )| A. | KHCO3和MgCO3 | B. | MgCO3和NaNO3 | C. | BaCO3和NaHCO3 | D. | Na2CO3和NaHCO3 |
分析 假设10g全部为CaCO3,与足量的盐酸反应,产生CO20.1mol,则样品中含碳量为:$\frac{12g/mol×0.1mol}{10g}$=12%,碳酸钙中C的质量分数为:$\frac{12}{100}$×100%,故杂质中杂质中含碳平均值为12%即可(且能与酸反应生成二氧化碳),据此对各选项进行判断.
解答 解:假设10g全部为CaCO3,与足量的盐酸反应,产生CO20.1mol,则样品中含碳量为:$\frac{12g/mol×0.1mol}{10g}$=12%,碳酸钙中C的质量分数为:$\frac{12}{100}$×100%,故杂质中杂质中含碳平均值为12%即可(且能与酸反应生成二氧化碳),
A.KHCO3的相对分子质量为100,样品中含碳量为12%,MgCO3的相对分子质量为84,含碳量为$\frac{12}{84}$,则二者的化合物中含碳量大于12%,不可能为二者的混合物,故A正确;
B.MgCO3的相对分子质量为84,含碳量为$\frac{12}{84}$,硝酸钠不反应,含碳量可以看做小于12%,则二者的化合物中含碳量可以为12%,可能为二者的混合物,故B错误;
C.BaCO3的相对分子质量为197,含碳量为$\frac{12}{197}$,NaHCO3中含碳量为$\frac{12}{84}$,二者的含碳量可以为12%,且都能够与盐酸反应,可能为二者的混合物,故C错误;
D.Na2CO3的相对分子质量为106,NaHCO3的相对分子质量为84,则碳的平均含量介于$\frac{12}{106}$~$\frac{12}{84}$之间,符合题意,可能为二者的混合物,故D错误;
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确平均值法及极值法的含义及应用方法为解答关键,试题侧重考查学生的分析能力及化学计算能力.

Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g);△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为283kJ | |
| B. |  如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | Na2O2(s)+CO(g)=Na2CO3(s);△H=-509kJ/mol | |
| D. | Na2O2(s)与CO2(g)反应放出226kJ热量时,电子转移数为2NA |
(2)室温下,无水硫酸铜溶于水的热方程式为CuSO4(s)═Cu2+(aq)+SO42-(aq)△H=-Q2 kJ•mol-1
(3)胆矾(CuSO4•5H2O)溶于水时溶液温度降低.则Q1与Q2的关系是(Q1、Q2为正数)( )
| A. | Q1>Q2 | B. | Q1=Q2 | C. | Q1<Q2 | D. | 无法确定 |
| A. | 溶液出现蓝色浑浊 | B. | 钠块熔成小球浮在水面四处游动 | ||
| C. | 有气体产生 | D. | 有红色的铜被置换出来 |
| A. | 4种 | B. | 6种 | C. | 10种 | D. | 14种 |
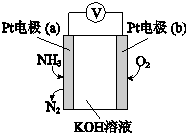
| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极b移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-═N2+6H2O |