题目内容
20.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图,下列说法不正确的是( )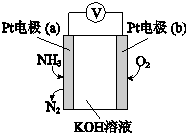
| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极b移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-═N2+6H2O |
分析 Pt电子通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原,结合电极方程式解答该题.
解答 解:A.氧气在b极发生还原反应,则b极为正极,a极为负极,故A正确;
B.因为a极为负极,则溶液中的阴离子向负极移动,则OH-向电极a移动,故B错误;
C.反应中N元素化合价升高3价,O元素化合价降低4价,根据得失电子守恒,消耗NH3与O2的物质的量之比为4:3,故C正确;
D.负极是氨气发生氧化反应变成氮气,且OH-向a极移动参与反应,故电极反应式为2NH3-6e-+6OH-=N2+6H2O,故D正确.
故选B.
点评 本题考查了原电池原理,根据O、N元素化合价变化判断正负极,再结合反应物、生成物及得失电子书写电极反应式,注意书写电极反应式时要结合电解质特点,为易错点.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
10.由10g含有杂质的CaCO3和足量盐酸反应,产生了0.1mol CO2,推断杂质的组成不可能是( )
| A. | KHCO3和MgCO3 | B. | MgCO3和NaNO3 | C. | BaCO3和NaHCO3 | D. | Na2CO3和NaHCO3 |
11.检验溶液中是否含有某种离子,下列操作方法正确的是( )
| A. | 加入AgNO3溶液,有白色沉淀生成,证明有Cl- | |
| B. | 用硝酸酸化后取上层清液,加入Ba(OH)2溶液,析出白色沉淀,证明有SO42- | |
| C. | 加浓NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝色的气体,证明有NH4+ | |
| D. | 加入盐酸,放出能使澄清石灰水变浑浊的气体,证明含有CO32- |
8.下列离子方程式正确的是( )
| A. | 足量的SO2通入氨水中:SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| B. | SO2通入溴水中:Br2+SO2+2H2O═2H++SO42-+2HBr | |
| C. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 酸雨久置pH变小:2H2SO3+O2═4H++2SO42- |
5.在一定温度下,下列叙述中属于可逆反应A(g)+B(g)?2C(g)达到平衡标志的是( )
| A. | C的生成速率与C的分解速率相等 | |
| B. | 混合气体的压强不再变化 | |
| C. | 单位时间内消耗a mol A的同时消耗a mol B | |
| D. | A、B、C的物质的量之比为1:1:2 |
9.在反应8NH3+3Cl2=N2+6NH4Cl中,被氧化的物质与被还原的物质的分子数之比为( )
| A. | 8:3 | B. | 3:8 | C. | 2:3 | D. | 1:3 |
 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: