题目内容
12. 现用邻苯二甲酸氢钾(本题中用KHA表示)标准溶液来测定某NaOH溶液的浓度,进行如下操作:
现用邻苯二甲酸氢钾(本题中用KHA表示)标准溶液来测定某NaOH溶液的浓度,进行如下操作:①用天平精确称取5.105g KHA(相对分子质量为204.2)固体配成250mL 的标准溶液.
②以酚酞作指示剂,用待测NaOH溶液滴定25.00mL KHA标准溶液,滴定终点时消耗NaOH溶液22.50mL.
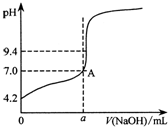
③在特定装置中,把50.00mL氢氧化钠溶液慢慢滴加到25.00mL KHA标准溶液中,整个过程溶液得到不断搅拌,通过仪器测得溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示.
请回答下列问题:
(l)操作①中所得KHA标准溶液的浓度是0.10mol/L.
(2)操作②中,NaOH溶液装在碱式滴定管中,滴定达到终点时的现象是溶液由无色变为浅红色且半分钟内不褪色.
(3)待测NaOH溶液的浓度是0.11mol/L.
(4)在图中A点,a<22.50mL(填“>”、“<”或“=”).
分析 (1)根据n=$\frac{m}{M}$,c=$\frac{n}{V}$计算;
(2)碱性溶液用碱式滴定管盛放;达到滴定终点时溶液变为弱碱性;
(3)根据c(NaOH)=$\frac{c(标准)×V(标准)}{V(NaOH)}$计算;
(4)根据酚酞变色判断终点,酚酞变色时,溶液显碱性.
解答 解:(1)用天平精确称取5.105g KHA(相对分子质量为204.2)固体配成250mL 的标准溶液,n=$\frac{m}{M}$=$\frac{5.105g}{204.2g/mol}$=0.025mol,则c=$\frac{n}{V}$=$\frac{0.025mol}{0.25L}$=0.10mol/L;
故答案为:0.10mol/L;
(2)碱性溶液用碱式滴定管盛放,则NaOH溶液应该用碱式滴定管盛放;达到滴定终点时溶液变为弱碱性,酚酞在弱碱性溶液中显浅红色,则滴定达到终点时溶液由无色变为浅红色且半分钟内不褪色;
故答案为:碱式滴定管;溶液由无色变为浅红色且半分钟内不褪色;
(3)用待测NaOH溶液滴定25.00mL KHA标准溶液,滴定终点时消耗NaOH溶液22.50mL,则c(NaOH)=$\frac{c(标准)×V(标准)}{V(NaOH)}$=$\frac{0.10mol/L×0.025L}{0.0225L}$=0.11mol/L,
故答案为:0.11mol/L;
(4)用待测NaOH溶液滴定25.00mL KHA标准溶液,是以酚酞为指示剂,根据酚酞变色判断终点,酚酞变色时溶液显碱性,图中A点时,溶液显中性,则反应消耗的氢氧化钠的体积小于22.50mL,
故答案为:<.
点评 本题考查了中和滴定操作、误差分析以及计算,题目难度中等,理解中和滴定的原理是解题关键,侧重于考查学生的实验能力和数据处理能力.

| A. | 二氧化硫、二氧化氮和二氧化碳的任意排放都会导致酸雨 | |
| B. | Na2O可用于呼吸面具中作为氧气的来源 | |
| C. | 向煤中加入适量生石灰,可大大减少燃烧产物中SO2的量 | |
| D. | 稀双氧水可作医疗消毒剂,说明H2O2对人体无害 |
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 室温时,零族元素的单质都是气体 | |
| D. | 同一周期中,卤族元素的第一电离能最大 |
 ;属于共价化合物(填“共价”或“离子”);
;属于共价化合物(填“共价”或“离子”);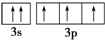 违背了泡利不相容原理;
违背了泡利不相容原理;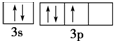 违背了洪特规则.
违背了洪特规则.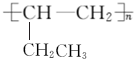 .
. 如图是制备二氧化硫制取和吸收装置(加热装置已省略)分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B.完成下列填空:
如图是制备二氧化硫制取和吸收装置(加热装置已省略)分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B.完成下列填空: 氯化铵
氯化铵 氢氧化钠
氢氧化钠
 ,二氧化碳
,二氧化碳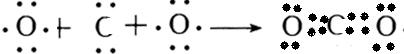
 W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题:
W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题: