题目内容
3.(1)CO2的电子式为 ;属于共价化合物(填“共价”或“离子”);
;属于共价化合物(填“共价”或“离子”);(2)H2O2的结构式为H-O-O-H,属于极性分子(填“极性”或“非极性”);
(3)SO42-中S原子的杂化方式为sp3,该微粒的空间构型为四面体结构;
(4)甲元素:
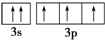 违背了泡利不相容原理;
违背了泡利不相容原理;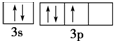 违背了洪特规则.
违背了洪特规则.
分析 (1)CO2含有C=O键,为共价化合物;
(2)H2O2中存在O-O、O-H键,为极性分子;
(3)判断价层电子对以及孤对电子数,可确定杂化类型和空间构型;
(4)同一轨道电子自旋方向不同,电子优先占据不同的轨道.
解答 解:(1)CO2含有C=O键,为共价化合物,电子式为 ,故答案为:
,故答案为: ;共价;
;共价;
(2)H2O2中存在O-O、O-H键,结构式为H-O-O-H,O为sp3杂质,结构不对称,为极性分子,故答案为:H-O-O-H;极性;
(3)SO42-中S形成4个σ键,孤对电子数为$\frac{6+2-2×4}{2}$=0,为sp3杂化,为四面体结构,故答案为:sp3;四面体结构;
(4)同一轨道电子自旋方向不同,甲违反泡利不相容原理,电子优先占据不同的轨道,乙违反洪特规则,故答案为:泡利不相容原理;洪特规则.
点评 本题考查较为综合,涉及电子式、分子的极性以及杂化、核外电子排布等知识,为高考常见题型和高频考点,侧重于基本概念的理解,难度不大,注意基础积累.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
13.下列不能用勒夏特列原理解释的是( )
| A. | 500℃时比室温更有利于合成氨的反应 | |
| B. | 红棕色的NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往加入过量的空气 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
14.乙酸乙酯与乙醛(CH3CHO)的混合物中氢元素的质量分数为$\frac{1}{11}$,则氧元素的质量分数为( )
| A. | $\frac{10}{11}$ | B. | $\frac{4}{25}$ | C. | $\frac{4}{11}$ | D. | $\frac{4}{5}$ |
11.漂白粉可由Cl2通入消石灰中制备,漂白粉的有效成分是( )
| A. | Ca(OH)2 | B. | CaCl2 | C. | Ca(ClO)2 | D. | CaCO3 |
18.如图代表周期表中的几种短周期元素,下列说法中错误的是( )
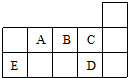

| A. | ED4分子中各原子均达8电子结构 | |
| B. | AD3和ED4两分子的中心原子均为sp3杂化 | |
| C. | A、B、C第一电离能的大小顺序为C>B>A | |
| D. | C、D气态氢化物稳定性强弱和沸点高低均为C>D |
8.下列各组离子在酸性溶液中能大量共存的是( )
| A. | Cu2+、Na+、SO42-、Cl- | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、Cl-、Ca2+、Na+ | D. | Fe2+、Na+、Cl-、NO3- |
15.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol甲基中含电子数目为7NA | |
| B. | 标准状况下,22.4L己烷中共价键数目为19NA | |
| C. | 14g乙烯和丁烯的混合物中含有的原子总数为3NA个 | |
| D. | 1mol苯乙烯(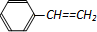 )中含有的C=C数为4NA )中含有的C=C数为4NA |
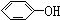 与
与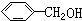
 与
与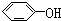
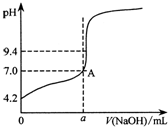 现用邻苯二甲酸氢钾(本题中用KHA表示)标准溶液来测定某NaOH溶液的浓度,进行如下操作:
现用邻苯二甲酸氢钾(本题中用KHA表示)标准溶液来测定某NaOH溶液的浓度,进行如下操作: