题目内容
11.下列说法中正确的是( )| A. | 同周期金属元素,原子失电子能力越强,最高化合价越高 | |
| B. | 同主族的单核阴离子,其还原性越强,水解程度越大 | |
| C. | IA和VIIA族元素间可形成共价化合物 | |
| D. | 第二周期元素从左到右最高化合价从+1到+7 |
分析 A、同周期金属元素原子失电子的能力与化合价的高低无关;
B、同主族碘离子还原性越强,但不能水解,而氟离子是弱离子能水解;
C、非金属元素之间一般形成共价化合物;
D、氧和氟无正价.
解答 解:A、同周期金属元素的原子失电子的能力与化合价的高低无关,如钠与铝,钠的失电子能力强于铝,但铝的最高正价高于钠,故A错误;
B、同主族碘离子还原性越强,但不能水解,而氟离子是弱离子能水解,所以同主族元素还原性越强越不易水解,故B错误;
C、非金属元素之间一般形成共价化合物,第IA族的H元素与第VIIA族的F、Cl等元素之间形成共价化合物,故C正确;
D、同一周期从左到右,元素的最高正化合价依次升高,但是第二周期中O、F元素没有最高正化合价,故D错误;
故选C.
点评 本题主要考查了元素周期律、共价化合物,难度不大,注意元素性质的递变性和规律性.

练习册系列答案
相关题目
1.室温下,在10mL0.1mol/LNH4Al(SO4)2溶液中,下列说法正确的是( )
| A. | 水电离出的c(H+)>10-7mol/L | |
| B. | c(Al3+)=c(NH4+)+c(NH3•H2O) | |
| C. | Ca2+、HCO3-、Na+、Cl-能在该溶液中大量共存 | |
| D. | 向该溶液中滴加10mL0.1mol/L NaOH溶液,无沉淀生成 |
2.卤代烃有者广泛的应用.下列说法正确的是( )
| A. | 多氯代甲烷中分子结构为正四面体的是CH2Cl2 | |
| B. | 氯代甲烷在常温下均为液体 | |
| C. | 乙烯可用于制取1,2-二氯乙烷和乙醇,前者为加成反应,后者为水解反应 | |
| D. | 麻醉剂三氟氯溴乙烷(CF3CHClBr)的同分异构体有3种(不考虑立体异构) |
6.仅用下表提供的仪器(夹持仪器和试剂任选),不能实现相应实验目的是( )
| 选项 | 实验目的 | 仪器 |
| A | 从食盐水中获得NaCl晶体 | 蒸发皿、玻璃棒、酒精灯 |
| B | 用稀H2SO4、Na2CO3溶液比较元素S与C的非金属性强弱 | 试管、胶头滴管 |
| C | 用8.0mol.L-1的盐酸配制 250mL1.5mol.L-1的盐酸 | 250m容量瓶,玻璃棒、烧杯 |
| D | 测定NaOH溶液的物质的量浓度 | 酸(碱)式滴定管,胶头滴管、锥形瓶、烧杯 |
| A. | A | B. | B | C. | C | D. | D |
16.下列离子方程式与实验事实相符且正确的是( )
| A. | 向AgI浊液中滴入NaCl溶液,产生大量白色沉淀:AgI(s)+Cl-(aq)=AgCl(s)+I-(aq) | |
| B. | 用氨水除去铝片表面的氧化膜:Al2O3+2NH3•H2O=2AlO2-+2NH4++H2O | |
| C. | 用铁氰化钾溶液检验Fe2+:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ | |
| D. | 向酸性KMnO4溶液中滴入过氧化氢产生无色气泡:2MnO4-+9H2O2+6H+=2Mn2++7O2↑+12H2O |
20.下列有关说法正确的是( )
| A. | 铁片镀锌时,铁片与外电源的正极相连 | |
| B. | 反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 0.1mol•L-1的CH3COOH溶液加水稀释,溶液的pH和其中水的电离程度均增大 | |
| D. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 |
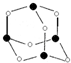 主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.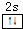 ,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.
,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.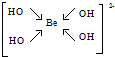 ,1mol该离子中含有的共价键数目为8NA.
,1mol该离子中含有的共价键数目为8NA.