题目内容
19.氯及其化合物在生活中应用广泛.(1)指出氯元素在周期表中的位置第三周期、ⅦA族
(2)将铁片插入盛有少量新制氯水试管中,无气泡产生,用长滴管吸取KSCN溶液滴入铁片附近,溶液变红色,然后红色消失.显红色的离子方程式为Fe3++3SCN-=Fe(SCN)3
(3)向新制氯水加入碳酸钙固体,可以收集2种气体(水蒸汽除外),写出分子式O2、CO2.
分析 (1)Cl的质子数为17,原子结构中有3个电子层,最外层电子数为7;
(2)显红色发生铁离子与KSCN溶液的络合反应;
(3)新制氯水加入碳酸钙固体,氯水中盐酸与碳酸钙反应,且HClO不稳定发生分解反应.
解答 解:(1)Cl的质子数为17,原子结构中有3个电子层,最外层电子数为7,则Cl元素位于周期表第三周期、ⅦA族,故答案为:第三周期、ⅦA族;
(2)显红色发生络合反应,其离子方程式为Fe3++3SCN-=Fe(SCN)3,故答案为:Fe3++3SCN-=Fe(SCN)3;
(3)新制氯水加入碳酸钙固体,氯水中盐酸与碳酸钙反应生成CO2,且HClO不稳定发生分解反应生成O2,故答案为:O2、CO2.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应等为解答的关键,侧重分析与应用能力的考查,注意氯水的成分,题目难度不大.

练习册系列答案
相关题目
9.如图所示装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的是( )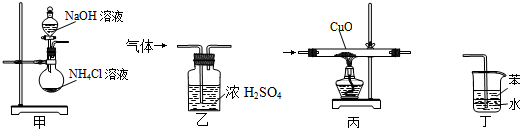

| A. | 用装置甲制取氨气 | B. | 用装置乙除去氨气中的水蒸气 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收氨气 |
10.一定条件下在水溶液中能大量共存的一组分子、离子是( )
| A. | 中性溶液中:K+、Fe3+、NO3-、Cl- | |
| B. | 酸性溶液中:HClO、K+、SO42-、I- | |
| C. | 强碱性溶液中:Ca2+、K+、HCO3-、NO3- | |
| D. | 碱性溶液中:Na+、SO32-、NO3-、S2- |
14.设NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,6.4g O2和O3的混合气体中含有的分子数为0.4 NA | |
| B. | 标准状况下,2.24 L CCl4分子中共价键的数目为0.4NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有氢氧根离子数为0.1 NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 10g46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| B. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| C. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| D. | 24g3H218O含有的中子数为10NA |
11.下列说法中正确的是( )
| A. | 同周期金属元素,原子失电子能力越强,最高化合价越高 | |
| B. | 同主族的单核阴离子,其还原性越强,水解程度越大 | |
| C. | IA和VIIA族元素间可形成共价化合物 | |
| D. | 第二周期元素从左到右最高化合价从+1到+7 |
8.工业上电解法制铝原理如图.下列说法正确的是( )
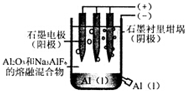

| A. | 电解过程中每转移12 mol电子,会产生2 molO2 | |
| B. | 加入助熔剂冰晶石(Na3AIF6)可降低电解的温度 | |
| C. | 电解过程中阳极反应式4A13++12e-→4Al | |
| D. | 若用该装置电解氯化铝溶液也能得到金属铝 |
 太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.