题目内容
20.下列有关说法正确的是( )| A. | 铁片镀锌时,铁片与外电源的正极相连 | |
| B. | 反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 0.1mol•L-1的CH3COOH溶液加水稀释,溶液的pH和其中水的电离程度均增大 | |
| D. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 |
分析 A、电镀时,镀件金属接电源的负极;
B、△H-T△S<0的反应能够自发进行;
C、稀醋酸加水稀释时,醋酸溶液的酸性减弱;
D、催化剂只能够加快反应速率,不影响平衡移动.
解答 解:A、铁片镀锌时,铁片与外电源的负极相连,锌片与电源正极相连,故A错误;
B、该反应的△S<0,反应能够自发进行,说明△H-T△S<0,所以必须△H<0,故B正确;
C、稀醋酸加水稀释时,醋酸酸性减弱,则pH增大,对水的电离的抑制程度减弱,水的电离程度增大,故C正确;
D、催化剂不影响平衡移动,加入催化剂反应物转化率不变,故D错误;
故选BC.
点评 本题考查了电镀原理、反应自发进行的条件、弱酸的加水稀释、催化剂的催化原理,题目难度不大.

练习册系列答案
相关题目
10.一定条件下在水溶液中能大量共存的一组分子、离子是( )
| A. | 中性溶液中:K+、Fe3+、NO3-、Cl- | |
| B. | 酸性溶液中:HClO、K+、SO42-、I- | |
| C. | 强碱性溶液中:Ca2+、K+、HCO3-、NO3- | |
| D. | 碱性溶液中:Na+、SO32-、NO3-、S2- |
11.下列说法中正确的是( )
| A. | 同周期金属元素,原子失电子能力越强,最高化合价越高 | |
| B. | 同主族的单核阴离子,其还原性越强,水解程度越大 | |
| C. | IA和VIIA族元素间可形成共价化合物 | |
| D. | 第二周期元素从左到右最高化合价从+1到+7 |
8.工业上电解法制铝原理如图.下列说法正确的是( )
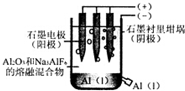

| A. | 电解过程中每转移12 mol电子,会产生2 molO2 | |
| B. | 加入助熔剂冰晶石(Na3AIF6)可降低电解的温度 | |
| C. | 电解过程中阳极反应式4A13++12e-→4Al | |
| D. | 若用该装置电解氯化铝溶液也能得到金属铝 |
15.下列装置应用于实验室从废旧的含CuI/SiO2催化剂中提取碘的实验,不能达到实验目的是( )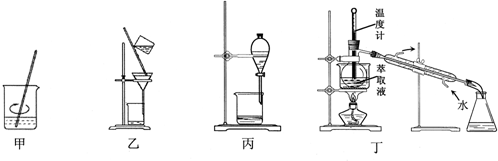

| A. | 用装置甲加稀H2SO4及H2O2氧化并用CCl4浸取 | |
| B. | 用装置乙过滤分离出浸取液 | |
| C. | 用装置丙分离得到碘的四氯化碳溶液 | |
| D. | 用装置丁分离萃取液中单质碘和四氯化碳 |
5.现有5种短周期元素X?Y?Z?Q?W,原子序数依次增大,在周期表中X原子的半径最小;X和W同主族;Y原子的核外电子总数是其次外层电子数的3倍,Q是地壳中含量最高的元素?下列说法不正确的是( )
| A. | 原子半径:Y<Q<W | |
| B. | ZX3可使紫色石蕊试液变蓝 | |
| C. | X?Z?Q可组成离子化合物或共价化合物 | |
| D. | X2Q2?Y2X6两种分子中含有的电子数?化学键种类都相同 |
 节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.