题目内容
3. 主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.(1)五种元素中第一电离能最小的是Be.电负性最大的是O(填元素符号).
(2)Y元素原子的价层电子的电子排布图为
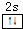 ,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.
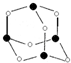
,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.(3)Z和N形成分子W的结构如图所示,化合物W的分子式为As4O6,Z、N原子的杂化类型分别为sp3、sp3.
(4)已知化合物NX3是剧毒的气体,与AgNO3溶液反应有黑色Ag析出,同时生成W,此反应是检验微量NX3的方法,该反应的化学方程式是4AsH3+24AgNO3+6H2O=As4O6+24Ag↓+24HNO3.
(5)画出配离子YZ4X42-的结构式
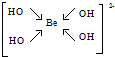 ,1mol该离子中含有的共价键数目为8NA.
,1mol该离子中含有的共价键数目为8NA.
分析 主族元素X、Y、Z、M、N的原子序数依次增大,Y原子的各能层电子数相同,核外电子排布为1s22s2,则Y为Be;Z原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素;N元素原子的4p轨道上有3个未成对电子,外围电子排布为4s24p3,则N为As元素;X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,则X为H元素、M为Cl,据此解答.
解答 解:主族元素X、Y、Z、M、N的原子序数依次增大,Y原子的各能层电子数相同,核外电子排布为1s22s2,则Y为Be;Z原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素;N元素原子的4p轨道上有3个未成对电子,外围电子排布为4s24p3,则N为As元素;X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,则X为H元素、M为Cl.
(1)五种元素中只有Be为金属元素,其第一电离能最小,氧元素与H、Cl、As形成的化合物中O表现负价,故O元素电负性最大,
故答案为:Be;O;
(2)Y元素原子核外电子排布为1s22s2,价层电子的电子排布图为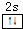 ,该元素的名称是铍.气态分子BeCl2中Be原子形成2个Be-Cl键,没有孤电子对,故为直线型结构,BeCl2可形成多聚体(YM2)n的原因是:BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键,
,该元素的名称是铍.气态分子BeCl2中Be原子形成2个Be-Cl键,没有孤电子对,故为直线型结构,BeCl2可形成多聚体(YM2)n的原因是:BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键,
故答案为: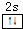 ;BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键;
;BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键;
(3)由分子W的结构图可知,该分子为A3B6型,故化合物W的分子式为As4O6,黑色球为As,白色球为O,O原子形成2个σ键,有2对孤对电子,轨道杂化数为4,O原子采取sp3杂化,As原子形成3个σ键,孤对电子w为$\frac{5-1×3}{2}$=1,轨道杂化数为4,As原子采取sp3杂化,
故答案为:As4O6;sp3;sp3;
(4)已知化合物AsX3是剧毒的气体,与AgNO3溶液反应有黑色Ag析出,同时生成As4O6,此反应是检验微量PX3的方法,该反应的化学方程式是:4AsH3+24AgNO3+6H2O=As4O6+24Ag↓+24HNO3,
故答案为:4AsH3+24AgNO3+6H2O=As4O6+24Ag↓+24HNO3;
(5)配离子YZ4X42-为[Be(OH)4]2-,Be2+提供空轨道,OH-提供孤对电子,其结构式为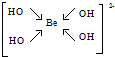 ,Be2+与OH-形成4个配位键、OH-中存在O-H键,1mol该离子中含有的共价键为8mol,含有共价键数目为8NA,
,Be2+与OH-形成4个配位键、OH-中存在O-H键,1mol该离子中含有的共价键为8mol,含有共价键数目为8NA,
故答案为: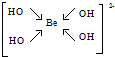 ;8NA.
;8NA.
点评 本题是对物质结构的考查,涉及核外电子排布、电负性、分子结构、杂化理论、配合物等,(1)中注意利用化合价判断电负性问题,(5)中共价键数目计算为易错点,学生容易忽略配位键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 钢铁生锈,负极反应式为:Fe-3e-=Fe3+ | |
| B. | 用石墨做电极电解硫酸铜溶液,有Cu和O2析出:2Cu2++4OH-$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2O | |
| C. | Na2CO3溶液滴加酚酞,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 酸性高锰酸钾溶液中加入草酸钠,溶液褪色:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O |
| A. | 常温常压下,6.4g O2和O3的混合气体中含有的分子数为0.4 NA | |
| B. | 标准状况下,2.24 L CCl4分子中共价键的数目为0.4NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有氢氧根离子数为0.1 NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
| A. | 同周期金属元素,原子失电子能力越强,最高化合价越高 | |
| B. | 同主族的单核阴离子,其还原性越强,水解程度越大 | |
| C. | IA和VIIA族元素间可形成共价化合物 | |
| D. | 第二周期元素从左到右最高化合价从+1到+7 |
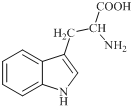 色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )
色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )| A. | 色氨酸的分子式为C11H12N2O2 | |
| B. | 色氨酸能发生取代、加成、酯化、中和反应 | |
| C. | 色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐 | |
| D. | 将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽 |
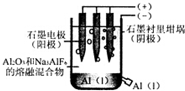
| A. | 电解过程中每转移12 mol电子,会产生2 molO2 | |
| B. | 加入助熔剂冰晶石(Na3AIF6)可降低电解的温度 | |
| C. | 电解过程中阳极反应式4A13++12e-→4Al | |
| D. | 若用该装置电解氯化铝溶液也能得到金属铝 |
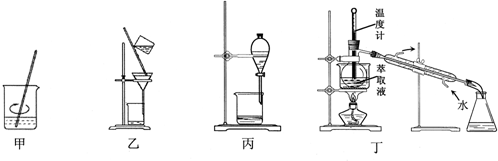
| A. | 用装置甲加稀H2SO4及H2O2氧化并用CCl4浸取 | |
| B. | 用装置乙过滤分离出浸取液 | |
| C. | 用装置丙分离得到碘的四氯化碳溶液 | |
| D. | 用装置丁分离萃取液中单质碘和四氯化碳 |
| A. | HF的电离常数是① | B. | HNO2的电离常数是① | ||
| C. | HCN的电离常数是② | D. | HNO2的电离常数是③ |
 节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.