题目内容
1.室温下,在10mL0.1mol/LNH4Al(SO4)2溶液中,下列说法正确的是( )| A. | 水电离出的c(H+)>10-7mol/L | |
| B. | c(Al3+)=c(NH4+)+c(NH3•H2O) | |
| C. | Ca2+、HCO3-、Na+、Cl-能在该溶液中大量共存 | |
| D. | 向该溶液中滴加10mL0.1mol/L NaOH溶液,无沉淀生成 |
分析 A、铵根离子和铝离子水解显酸性,溶液中水电离出的氢离子浓度大于10-7;
B、依据物料守恒分析,铝离子水解生成氢氧化铝,铵根离子水解生成一水合氨,氮元素物质的量和铝元素物质的量相同分析判断;
C、Al3+和碳酸氢根离子发生双水解;
D、向该溶液中滴加10mL0.1mol/L NaOH溶液,依据化学反应优先原则,先和铝离子反应生成沉淀.
解答 解:A、在10mL0.1mol/LNH4Al(SO4)2溶液中,铵根离子和铝离子水解结合水中氢氧根离子,溶液都显酸性,溶液中水电离出的氢离子浓度大于10-7,故A正确;
B、依据物料守恒分析,铝离子水解生成氢氧化铝,铵根离子水解生成一水合氨,氮元素物质的量和铝元素物质的量相同分析判断,c[Al(OH)3]+c(Al3+)=c(NH4+)+c(NH3•H2O),故B错误;
C、Al3+和碳酸氢根离子发生双水解生成二氧化碳和氢氧化铝沉淀,所以Ca2+、HCO3-、Na+、Cl-不能在该溶液中大量共存,故C错误;
D、向该溶液中滴加10mL0.1mol/L NaOH溶液,依据化学反应优先原则,氢氧根离子先和铝离子反应生成沉淀,所以开始有沉淀生成,故D错误;
故选A.
点评 本题考查了盐类水解原理分析,电解质溶液中物料守恒分析应用,注意离子反应的分析判断,掌握离子性质和盐类水解实质是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列有关实验叙述正确的是( )
| A. | 除去苯中混有少量的苯酚可加人浓溴水后过滤 | |
| B. | 向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液裉色,说明维生素C具有还原性 | |
| C. | 在淀粉溶液中加稀硫酸并加热后,加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 | |
| D. | 将Na2SO3溶液蒸干,灼烧至恒重,最终剩余固体是Na2SO3 |
12.常温下,下列是生活中常见物质的pH,其中碱性最强的是( )
| A. | 厕所清洁剂pH=1 | B. | 食醋pH=3 | C. | 肥皂水pH=10 | D. | 厨房洗涤剂pH=12 |
9.如图所示装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的是( )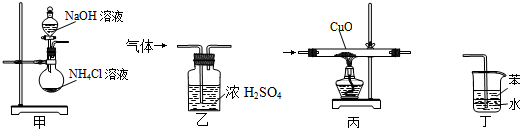

| A. | 用装置甲制取氨气 | B. | 用装置乙除去氨气中的水蒸气 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收氨气 |
16.下列解释实验事实的方程式正确的是( )
| A. | 纯碱溶液可以清洗油污的原因:CO32-+2H2O?H2CO3+2OH- | |
| B. | 在强碱溶液中NaClO与Fe(OH)3反应制备Na2FeO4:3ClO-+2Fe(OH)3+4OH?=2FeO42-+3Cl-+5H2O | |
| C. | 铜制品表面的水膜酸性较强时,发生电化学腐蚀,正极反应为2H++2e-=H2↑ | |
| D. | 向AgNO3溶液中加过量NaCl后再加Na2S溶液,白色沉淀变黑色 2Ag++S2-=Ag2S↓ |
6.下列有关叙述,正确的是( )
| A. | 加碘食盐能使淀粉溶液变蓝 | |
| B. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物属于胶体 | |
| C. | 装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 | |
| D. | 煤经过气化和液化两种物理变化,可变为清洁能源 |
13.下列解释事实的方程式正确的是( )
| A. | 钢铁生锈,负极反应式为:Fe-3e-=Fe3+ | |
| B. | 用石墨做电极电解硫酸铜溶液,有Cu和O2析出:2Cu2++4OH-$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2O | |
| C. | Na2CO3溶液滴加酚酞,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 酸性高锰酸钾溶液中加入草酸钠,溶液褪色:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O |
10.一定条件下在水溶液中能大量共存的一组分子、离子是( )
| A. | 中性溶液中:K+、Fe3+、NO3-、Cl- | |
| B. | 酸性溶液中:HClO、K+、SO42-、I- | |
| C. | 强碱性溶液中:Ca2+、K+、HCO3-、NO3- | |
| D. | 碱性溶液中:Na+、SO32-、NO3-、S2- |
11.下列说法中正确的是( )
| A. | 同周期金属元素,原子失电子能力越强,最高化合价越高 | |
| B. | 同主族的单核阴离子,其还原性越强,水解程度越大 | |
| C. | IA和VIIA族元素间可形成共价化合物 | |
| D. | 第二周期元素从左到右最高化合价从+1到+7 |