题目内容
15.某同学设计了如下的实验: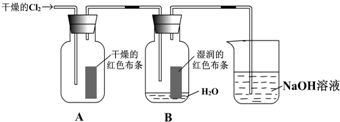
(1)通入Cl2后,集气瓶A中干燥的红色布条的现象是不褪色;集气瓶B中湿润的红色布条的现象是褪色;可得出的结论是干燥Cl2没有漂白性,Cl2与水反应生成HClO有漂白性.
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是盐酸是否能使红布条褪色.
分析 Cl2与H2O反应生成HClO,反应的化学方程式为Cl2+H2O=HCl+HClO,具有漂白性的物质为HClO,如确证,可检验盐酸是否能使红布条褪色,干燥的氯气不具有漂白性,不能使干燥有色布条褪色,氯气可与氢氧化钠反应生成氯化钠、次氯酸钠和水,可用于氢氧化钠吸收尾气,以此解答该题.
解答 解:(1)通入Cl2后,干燥的氯气没有漂白性,集气瓶A中干燥的红色布条不褪色,Cl2与H2O反应生成HClO,反应的化学方程式为Cl2+H2O=HCl+HClO,具有漂白性的物质为HClO,则集气瓶B中湿润的红色布条褪色,
故答案为:不褪色;褪色;干燥Cl2没有漂白性,Cl2与水反应生成 HClO有漂白性;
(2)Cl2+H2O?HCl+HClO,所以需要设计一个实验在一个红色布条上滴加盐酸,布条无变化,排除氯化氢的漂白性,就证明起漂白作用的物质是次氯酸,
故答案为:盐酸是否能使红布条褪色.
点评 本题考查HClO的漂白性的探究,题目难度不大,本题注意氯气与次氯酸性质的差异性,注意有关反应化学方程式或者离子方程式的书写,把握反应的原理.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
5.设nA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 1mol C2H6含有6nA个共价键 | |
| B. | 标准状况下,22.4L氯水含有nA个Cl2分子 | |
| C. | 17gNH3含有10nA个质子 | |
| D. | 1molK被完全氧化生成KO2,失去2nA个电子 |
6.2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述正确的是( )
| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够发生取代反应 | |
| D. | 丙烷的熔点比乙烷低 |
3.关于化学键的下列叙述中,不正确的是( )
| A. | 离子化合物中可能含有共价键 | B. | 共价化合物中一定不含离子键 | ||
| C. | 离子化合物中肯定只含离子键 | D. | 共价化合物中含有共价键 |
20.下列物质分类正确的是( )
| A. | 非电解质:NH3 | B. | 氧化物:H2C2O4 | ||
| C. | 混合物:KAl(SO4)2•12H2O | D. | 强酸:HClO |
4.化学是一门以实验为基础的学科,弄清实验原理和细致观察实验现象是一种重要的能力.
Ⅰ.某同学利用1mol/L KI溶液、0.1mol/L H2SO4溶液和淀粉溶液探究溶液出现蓝色的时间与温度的关系.
(1)用离子方程式解释实验原理4H++4I-+O2=2I2+2H2O
(2)实验时,试剂加入顺序为①KI溶液、②淀粉溶液、③稀H2SO4溶液,试解释②③的顺序为何不能颠倒若②③顺序颠倒,则I2生成后不能立刻被检测到(溶液变蓝).
Ⅱ.某化学小组发现草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,为了探究其主要原因,进行了如下实验:
【实验原理】5H2C2O4+2MnO4-+6H+═10CO2↑+2Mn2++8H2O
【探究记录及分析】
(1)该实验采用了单一变量法,其中,实验①④对比是为了探究K+是否对反应速率有影响,实验①②对比是为了探究温度是否对反应速率有影响.
(2)x=25
(3)不能(填“能”、“不能”)用MnCl2固体代替MnSO4固体.
【探究结论】
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但随后查阅已有的文献资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.

结合文献资料与实验得出:草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色先慢后快的主要原因是草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,生成的MnSO4(Mn2+)对该反应有催化作用.
Ⅰ.某同学利用1mol/L KI溶液、0.1mol/L H2SO4溶液和淀粉溶液探究溶液出现蓝色的时间与温度的关系.
(1)用离子方程式解释实验原理4H++4I-+O2=2I2+2H2O
(2)实验时,试剂加入顺序为①KI溶液、②淀粉溶液、③稀H2SO4溶液,试解释②③的顺序为何不能颠倒若②③顺序颠倒,则I2生成后不能立刻被检测到(溶液变蓝).
Ⅱ.某化学小组发现草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,为了探究其主要原因,进行了如下实验:
【实验原理】5H2C2O4+2MnO4-+6H+═10CO2↑+2Mn2++8H2O
【探究记录及分析】
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| ① | 30 | 20 | 30 | 20 | 18 | |
| ② | 30 | 20 | 30 | 20 | 温度65℃ | 13 |
| ③ | 30 | 20 | 30 | 20 | 少量MnSO4固体 | 3.6 |
| ④ | 30 | 20 | x | 20 | 5mL 10mol/L K2SO4溶液 | 18 |
(2)x=25
(3)不能(填“能”、“不能”)用MnCl2固体代替MnSO4固体.
【探究结论】
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但随后查阅已有的文献资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.

结合文献资料与实验得出:草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色先慢后快的主要原因是草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,生成的MnSO4(Mn2+)对该反应有催化作用.
18.太阳能的开发和利用是21世纪一个重要课题.利用储能介质储存太阳能的原理是:白天在太阳照射下某种盐熔化,吸收热量,晚间熔盐固化释放出相应的能量,已知数据:
其中最适宜选用作为储能介质的是( )
| 盐 | 熔点(℃) | 熔化吸热(kJ•mol-1) | 参考价格(元•t-1) |
| CaCl2•6H2O | 29.9 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 35.1 | 100.1 | 1 600~2 000 |
| Na2S2O3•5H2O | 45.0 | 49.7 | 1 400~1 800 |
| A. | CaCl2•6H2O | B. | Na2SO4•10H2O | C. | Na2HPO4•12H2O | D. | Na2S2O3•5H2O |
 .
.