题目内容
14.下列说法不正确的是( )| A. | HCl、HBr、HI的熔点沸点升高与范德华力大小有关 | |
| B. | H2O的熔点沸点大于H2S的是由于H2O分子之间存在氢键 | |
| C. | 乙醇与水互溶可以用相似相溶原理解释 | |
| D. | 甲烷与水分子间不能形成氢键这种化学键 |
分析 HCl、HBr、HI,都不含氢键,都为分子晶体,决定熔沸点高低的因素是分子间作用力,含有氢键的分子晶体,沸点较高,但氢键不属于化学键,结合相似相溶原理解答该题.
解答 解:A.HCl、HBr、HI,都不含氢键,都为分子晶体,决定熔沸点高低的因素是分子间作用力,相对分子质量越大,分子间作用力越强,则熔沸点越高,故A正确;
B.水分子间存在氢键,所以H2O的熔点沸点大于H2S,故B正确;
C.乙醇和水都为极性分子,且之间可形成氢键,乙醇与水混溶,故C正确;
D.C的非金属性较弱,不能形成氢键,氢键是分子间作用力,不是化学键,故D错误;
故选D.
点评 本题考查较为综合,涉及沸点高低的比较,氢键,相似相溶等问题,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
4.下列各组物质间,一定互为同系物的是( )
| A. | C2H6O和C4H10O | B. | C3H6O2和C4H8O2 | C. | C4H10和C10H22 | D. | C3H4和C4H6 |
5.设nA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 1mol C2H6含有6nA个共价键 | |
| B. | 标准状况下,22.4L氯水含有nA个Cl2分子 | |
| C. | 17gNH3含有10nA个质子 | |
| D. | 1molK被完全氧化生成KO2,失去2nA个电子 |
2.下列分子的键角均是109°28′的是( )
| A. | P4 | B. | CH2Cl2 | C. | NH3 | D. | CCl4 |
9.判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.如下表所示
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性.由此可推出它们的结构式分别为 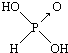 和
和 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
(2)亚磷酸和亚砷酸与过量的氢氧化钠溶液反应的化学方程式分别为:①H3PO3+2NaOH=Na2HPO3+2H2O; ②H3AsO3+3NaOH=Na3AsO3+3H2O.
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 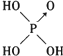 | 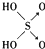 |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 和
和 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性(2)亚磷酸和亚砷酸与过量的氢氧化钠溶液反应的化学方程式分别为:①H3PO3+2NaOH=Na2HPO3+2H2O; ②H3AsO3+3NaOH=Na3AsO3+3H2O.
6.2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述正确的是( )
| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够发生取代反应 | |
| D. | 丙烷的熔点比乙烷低 |
3.关于化学键的下列叙述中,不正确的是( )
| A. | 离子化合物中可能含有共价键 | B. | 共价化合物中一定不含离子键 | ||
| C. | 离子化合物中肯定只含离子键 | D. | 共价化合物中含有共价键 |
4.化学是一门以实验为基础的学科,弄清实验原理和细致观察实验现象是一种重要的能力.
Ⅰ.某同学利用1mol/L KI溶液、0.1mol/L H2SO4溶液和淀粉溶液探究溶液出现蓝色的时间与温度的关系.
(1)用离子方程式解释实验原理4H++4I-+O2=2I2+2H2O
(2)实验时,试剂加入顺序为①KI溶液、②淀粉溶液、③稀H2SO4溶液,试解释②③的顺序为何不能颠倒若②③顺序颠倒,则I2生成后不能立刻被检测到(溶液变蓝).
Ⅱ.某化学小组发现草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,为了探究其主要原因,进行了如下实验:
【实验原理】5H2C2O4+2MnO4-+6H+═10CO2↑+2Mn2++8H2O
【探究记录及分析】
(1)该实验采用了单一变量法,其中,实验①④对比是为了探究K+是否对反应速率有影响,实验①②对比是为了探究温度是否对反应速率有影响.
(2)x=25
(3)不能(填“能”、“不能”)用MnCl2固体代替MnSO4固体.
【探究结论】
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但随后查阅已有的文献资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.

结合文献资料与实验得出:草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色先慢后快的主要原因是草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,生成的MnSO4(Mn2+)对该反应有催化作用.
Ⅰ.某同学利用1mol/L KI溶液、0.1mol/L H2SO4溶液和淀粉溶液探究溶液出现蓝色的时间与温度的关系.
(1)用离子方程式解释实验原理4H++4I-+O2=2I2+2H2O
(2)实验时,试剂加入顺序为①KI溶液、②淀粉溶液、③稀H2SO4溶液,试解释②③的顺序为何不能颠倒若②③顺序颠倒,则I2生成后不能立刻被检测到(溶液变蓝).
Ⅱ.某化学小组发现草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,为了探究其主要原因,进行了如下实验:
【实验原理】5H2C2O4+2MnO4-+6H+═10CO2↑+2Mn2++8H2O
【探究记录及分析】
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| ① | 30 | 20 | 30 | 20 | 18 | |
| ② | 30 | 20 | 30 | 20 | 温度65℃ | 13 |
| ③ | 30 | 20 | 30 | 20 | 少量MnSO4固体 | 3.6 |
| ④ | 30 | 20 | x | 20 | 5mL 10mol/L K2SO4溶液 | 18 |
(2)x=25
(3)不能(填“能”、“不能”)用MnCl2固体代替MnSO4固体.
【探究结论】
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但随后查阅已有的文献资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.

结合文献资料与实验得出:草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色先慢后快的主要原因是草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,生成的MnSO4(Mn2+)对该反应有催化作用.
 氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节.
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节.