题目内容
12.用无机矿物资源生产部分材料,其产品流程示意图如下.下列有关说法不正确的是( )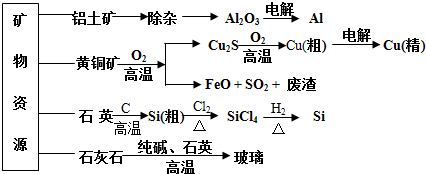
| A. | 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO | |
| B. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
分析 A.制取玻璃时,碳酸钙和纯碱反应生成二氧化碳,和石英反应生成二氧化碳;制取粗硅时,二氧化硅和C反应生成CO;
B.SO2可以转化成SO3,进而生成H2SO4;FeO与CO在高温下可生成Fe;
C.制备硅的过程中,利用沸点不同进行分馏,将SiCl4从杂质中提取出来,再与H2发生置换反应得到高纯硅;
D.生产玻璃涉及到的反应有SiO2+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑和SiO2+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑.
解答 解:A.生产玻璃涉及到的反应有SiO2+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑和SiO2+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,所以石灰石、纯碱和二氧化硅在高温下反应生成二氧化碳气体,石英和碳在高温下反应生成硅和一氧化碳,故A正确;
B.SO2可以转化成SO3,三氧化硫是生成硫酸的成分,进而生成H2SO4;CO具有还原性,FeO与CO在高温下可生成Fe,故B正确;
C.制备硅的过程中,利用沸点不同进行分馏,将SiCl4从杂质中提取出来,再与H2发生置换反应得到高纯硅,故C正确;
D.生产玻璃涉及到的反应有SiO2+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑和SiO2+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,
元素化合价没有发生变化,不是氧化还原反应,故D错误;
故选D.
点评 本题考查元素化合物知识,侧重考查金属冶炼,明确元素化合物性质是解本题关键,知道涉及的反应有哪些,熟悉反应原理,题目难度不大.

| A. | P4 | B. | CH2Cl2 | C. | NH3 | D. | CCl4 |
| A. | 离子化合物中可能含有共价键 | B. | 共价化合物中一定不含离子键 | ||
| C. | 离子化合物中肯定只含离子键 | D. | 共价化合物中含有共价键 |
| A. | 非电解质:NH3 | B. | 氧化物:H2C2O4 | ||
| C. | 混合物:KAl(SO4)2•12H2O | D. | 强酸:HClO |
Ⅰ.某同学利用1mol/L KI溶液、0.1mol/L H2SO4溶液和淀粉溶液探究溶液出现蓝色的时间与温度的关系.
(1)用离子方程式解释实验原理4H++4I-+O2=2I2+2H2O
(2)实验时,试剂加入顺序为①KI溶液、②淀粉溶液、③稀H2SO4溶液,试解释②③的顺序为何不能颠倒若②③顺序颠倒,则I2生成后不能立刻被检测到(溶液变蓝).
Ⅱ.某化学小组发现草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,为了探究其主要原因,进行了如下实验:
【实验原理】5H2C2O4+2MnO4-+6H+═10CO2↑+2Mn2++8H2O
【探究记录及分析】
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| ① | 30 | 20 | 30 | 20 | 18 | |
| ② | 30 | 20 | 30 | 20 | 温度65℃ | 13 |
| ③ | 30 | 20 | 30 | 20 | 少量MnSO4固体 | 3.6 |
| ④ | 30 | 20 | x | 20 | 5mL 10mol/L K2SO4溶液 | 18 |
(2)x=25
(3)不能(填“能”、“不能”)用MnCl2固体代替MnSO4固体.
【探究结论】
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但随后查阅已有的文献资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.

结合文献资料与实验得出:草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色先慢后快的主要原因是草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,生成的MnSO4(Mn2+)对该反应有催化作用.
| A. | 在相同温度下,甲酸溶液比盐酸溶液的导电性弱 | |
| B. | 甲酸能与NaHCO3作用放出CO2气体 | |
| C. | 等体积、等物质的量浓度甲酸溶液与NaOH溶液混合时恰好完全中和 | |
| D. | 室温下,1mol/L的甲酸溶液的pH=2 |
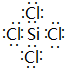 .
. 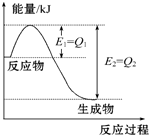 如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.
如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1. 甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置:
甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置: