题目内容
19.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 酸性溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 碱性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
分析 A.酸性溶液中存在大量氢离子,碳酸根离子与氢离子反应;
B.次氯酸根离子能够氧化碘离子;
C.四种离子之间不反应,都不与碳酸氢铵反应;
D.硫氰根离子与氯化铁反应生成硫氰化铁.
解答 解:A.CO32-与酸性溶液中的氢离子反应,在溶液中不能大量共存,故A错误;
B.ClO-、I-之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.K+、Na+、NO3-、Cl-之间不发生反应,都不与K+、Na+、NO3-、Cl-反应,在溶液中能够大量共存,故C正确;
D.FeCl3溶液中含有Fe3+,Fe3+、SCN-之间发生反应生成络合物硫氰化铁,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查了离子共存的判断,题目难度中等,明确离子反应发生条件为解答关键,注意掌握题中暗含条件的含义,合理把握离子不能共存的情况,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
5.下列有关材料的说法正确的是( )
| A. | 金刚石因其硬度大和熔点高,所以人们目前还不能进行人工合成 | |
| B. | 无机非金属材料、金属材料和高分子材料都是我们生活和生产中不可缺少的材料,但高分子材料的共同特点是熔点低、硬度小,因此不耐高温 | |
| C. | 钛合金是新兴的形状记忆合金,将它置于人的大脑可以增强记忆功能 | |
| D. | 金属腐蚀会带来严重的危害和损失,但也可被用来进行材料加工 |
7.下列有关生活中的化学,说法不正确的是( )
| A. | 食用植物油的主要成分是高级不饱和脂肪酸甘油酯 | |
| B. | 福尔马林可制备标本是利用了使蛋白质变性的性质 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 银氨溶液可以用于区分麦芽糖和蔗糖 |
4. NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )
NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )
 NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )
NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )| A. | 0℃时,饱和的NaCl和NH4Cl混合溶液中,NaCl的物质的量浓度是NH4Cl的2倍 | |
| B. | 30℃时,饱和的NaCl和NH4Cl混合溶液中,两者的物质的量浓度相等 | |
| C. | 通入的气体可能是NH3,控制在0~10℃结晶出NH4Cl | |
| D. | 通入的气体可能是CO2,控制在30~40℃结晶出NH4Cl |
11.下列排列顺序正确的是( )
| A. | 原子序数:C>Li>B | B. | 元素的非金属性:N>O>F | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 氢化物的稳定性:HF>HCl>HBr |
8.下列排序不正确的是( )
| A. | 稳定性 PH3<H2S<HCl | B. | 沸点高低 NH3<PH3<AsH3 | ||
| C. | 还原性 Br-<Fe2+<I- | D. | 微粒半径 K+<Cl?<S2? |
 .
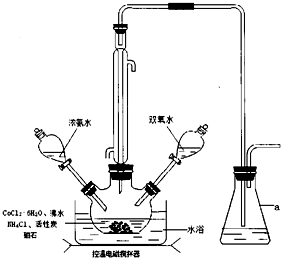
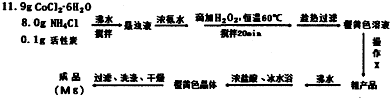
.
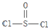 )是一种很重要的化学试剂,可以作为氯化剂和脱水剂.氯化亚砜分子的几何构型是三角锥形;中心原子采取SP3杂化方式.
)是一种很重要的化学试剂,可以作为氯化剂和脱水剂.氯化亚砜分子的几何构型是三角锥形;中心原子采取SP3杂化方式.