题目内容
11.下列排列顺序正确的是( )| A. | 原子序数:C>Li>B | B. | 元素的非金属性:N>O>F | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 氢化物的稳定性:HF>HCl>HBr |
分析 A.这几种元素原子序数分别是6、3、5;
B.同一周期元素,元素非金属性随着原子序数增大而增强;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.这几种元素原子序数分别是6、3、5,所以原子序数C>B>Li,故A错误;
B.同一周期元素,元素非金属性随着原子序数增大而增强,所以非金属性F>O>N,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P,所以其最高价氧化物的水化物酸性H3PO4<H2SO4<HClO4,故C错误;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>Br,所以氢化物的稳定性HF>HCl>HBr,故D正确;
故选D.
点评 本题考查元素周期律,明确同一周期元素原子结构及其元素周期律是解本题关键,知道非金属性强弱判断方法,知道非金属性强弱与其单质的氧化性、氢化物的稳定性、最高价含氧酸酸性强弱关系,题目难度不大.

练习册系列答案
相关题目
17.在某温度下,NaOH的溶解度为20克,该温度下将40克NaOH放入110克水中,充分搅拌后,测的溶液的密度为1.2g/mL,则溶液中溶质的物质的量浓度为( )
| A. | 5.0mol/L | B. | 0.02mol/L | C. | 2.0mol/L | D. | 0.8mol/L |
2.废钒催化剂提取纯净V2O5的一种流程如图一所示:
(1)废钒催化剂需粉碎处理,目的是加快反应速率.
(2)填写并配平步骤②中的离子反应方程式.
6VO2++1C1O3-+6H2O=3V2O5↓+1Cl-+12H+;
(3)根据图二和下表信息,步骤②调节pH的合适范围是2.0~2.5.
溶液中有关离子沉淀的pH
(4)V2O5和NaOH溶液反应的化学方程式为V2O5+2NaOH=2NaVO3+H2O.
(5)步骤④中需加人硫酸,其原因是使NH4+的水解平衡向逆方向移动,增加NH4+的离子浓度,增加NH4VO3的产量.
(6)焙烧产生的气体用硫酸吸收后,其产物可以在该工艺中循环利用.
(7)V2O5可制成某电池的电解液.该电池的总反应为:VO2++2H++V2+?V3+VO2++H2O,则放电时的负极产物为V3+.

(1)废钒催化剂需粉碎处理,目的是加快反应速率.
(2)填写并配平步骤②中的离子反应方程式.
6VO2++1C1O3-+6H2O=3V2O5↓+1Cl-+12H+;
(3)根据图二和下表信息,步骤②调节pH的合适范围是2.0~2.5.
| 开始沉淀pH | 完全沉淀pH | |
| Fe(OH)2 | 6.5 | 9.7 |
| Fe(OH)3 | 2.5 | 3.7 |
(4)V2O5和NaOH溶液反应的化学方程式为V2O5+2NaOH=2NaVO3+H2O.
(5)步骤④中需加人硫酸,其原因是使NH4+的水解平衡向逆方向移动,增加NH4+的离子浓度,增加NH4VO3的产量.
(6)焙烧产生的气体用硫酸吸收后,其产物可以在该工艺中循环利用.
(7)V2O5可制成某电池的电解液.该电池的总反应为:VO2++2H++V2+?V3+VO2++H2O,则放电时的负极产物为V3+.
19.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 酸性溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 碱性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
6.下列说法错误的是( )
| A. | 鸡蛋清和淀粉可以用浓硝酸鉴别 | |
| B. | 用甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| C. | 分子式为C5H8O2,既与碳酸钠溶液反应又与溴的四氯化碳溶液反应的有机物有8种 | |
| D. | 乳酸薄荷醇酯(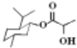 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 |
16. 据媒体报道,一些非法油厂用大豆油、棕榈油、粗制棉油等添加香精勾兑成花生油.如图就是一种香精的结构,下列对该香精的叙述不正确的是( )
据媒体报道,一些非法油厂用大豆油、棕榈油、粗制棉油等添加香精勾兑成花生油.如图就是一种香精的结构,下列对该香精的叙述不正确的是( )
 据媒体报道,一些非法油厂用大豆油、棕榈油、粗制棉油等添加香精勾兑成花生油.如图就是一种香精的结构,下列对该香精的叙述不正确的是( )
据媒体报道,一些非法油厂用大豆油、棕榈油、粗制棉油等添加香精勾兑成花生油.如图就是一种香精的结构,下列对该香精的叙述不正确的是( )| A. | 该香精能够水解,其水解产物中有醇 | |
| B. | 该香精能够使酸性KMnO4溶液褪色 | |
| C. | 该香精能够与溴水发生加成反应 | |
| D. | 1 mol该香精中含有1 mol碳氧双键和4 mol碳碳双键 |
3. 硝苯地平缓释片(简称NSRT)是一种用于治疗各种类型的高血压及心绞痛的新药,其结构式如图所示.下列关于硝苯地平缓释片的说法正确的是( )
硝苯地平缓释片(简称NSRT)是一种用于治疗各种类型的高血压及心绞痛的新药,其结构式如图所示.下列关于硝苯地平缓释片的说法正确的是( )
 硝苯地平缓释片(简称NSRT)是一种用于治疗各种类型的高血压及心绞痛的新药,其结构式如图所示.下列关于硝苯地平缓释片的说法正确的是( )
硝苯地平缓释片(简称NSRT)是一种用于治疗各种类型的高血压及心绞痛的新药,其结构式如图所示.下列关于硝苯地平缓释片的说法正确的是( )| A. | NSRT的分子式为C18H17N2O6 | |
| B. | 1molNSRT在水溶液中最多能消耗2molNaOH | |
| C. | NSRT不能使酸性高锰酸钾溶液褪色 | |
| D. | 1mol NSRT在一定条件下能和7molH2发生加成反应 |
20.下列反应的离子方程式正确( )
| A. | 铜与稀硝酸反应 Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O | |
| B. | 稀碳酸钠溶液中通入二氧化碳 CO32-+CO2+H2O=2HCO3- | |
| C. | 在氯化铝溶液中滴入氨水 Al3++4NH3•H2O=AlO2-+4NH4+ | |
| D. | 向次氯酸钙溶液中通入SO2 Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
1.某无色溶液中可能含有H+、OH-、K+、NO3-,加入铝粉后,只产生H2.试回答:
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)甲同学分析:若H+大量存在,则NO3-就不能大量存在.设计实验证实如表:
①盐酸溶解Al2O3薄膜的离子方程式是6H++Al2O3═2Al3++3H2O.
②根据现象Ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
a.浅棕色气体是NO2.
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,写出该反应的离子方程式:Al+NO3?+4H+═Al3++NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.重新设计实验证实如表:
为确认“刺激性气味”气体,进行如下实验:用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝. 则:
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成.实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.因此无色溶液一定能大量存在的是K+、OH-.
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)甲同学分析:若H+大量存在,则NO3-就不能大量存在.设计实验证实如表:
| 装 置 | 现 象 |
 | Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 Ⅲ.试管变热,溶液沸腾 |
②根据现象Ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,写出该反应的离子方程式:Al+NO3?+4H+═Al3++NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.重新设计实验证实如表:
| 装置 | 现象 |
 | Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,有刺激性气味 |
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成.实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.因此无色溶液一定能大量存在的是K+、OH-.