题目内容
14.三氯化六氨合钴([Co(NH3)6]Cl3,Mr=267.5g•mol-1,橙黄色晶体)是合成其它含钴配合物的重要原料,它难溶于乙醇,微溶于盐酸,稍溶于水,常温下较稳定,强热时部分分解,实验室制备三氯化六氨合钴的反应原理为:2CoCl2•6H2O+10NH3•H2O+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+24H2O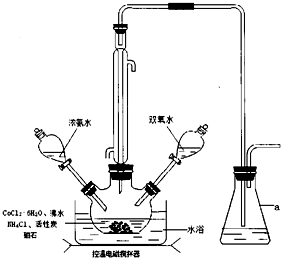
实验装置如图,具体流程如下:
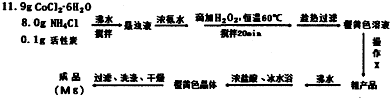
请回答下列问题:
(1)仪器a的名称为锥形瓶.加入双氧水的操作方法是打开分液漏斗的玻璃塞,再旋转玻璃活塞,逐滴加入过氧化氢.
(2)操作X为冷却结晶、过滤.
(3)活性炭在本实验中的作用主要是催化剂.
(4)提纯粗产品时,加入浓盐酸并冰水浴冷却的目的是促进[Co(NH3)6]Cl3晶体析出,减少产品溶解损失.
(5)洗涤橙黄色晶体,下列方法中最合适的是A.
A.先用盐酸洗,后用乙醇洗
B.先用盐酸洗,后用冷水洗
C.先用冷水洗,后用乙醇洗
D.先用乙醇洗,后用冷水洗
(6)本实验在干燥成品时,一般采用沸水浴干燥的方式,可能的原因是温度过高时产品易分解,温度过低干燥时间过长.
(7)称取$\frac{M}{5}$g成品溶于NaOH溶液中,煮沸蒸出全部NH3后将溶液用酸酸化,加入50.00mL0.5000mol•L-1的KI溶液(过量)和淀粉指示剂,然后用0.2000mol•L-1的Na2S2O3标准溶液滴定,至终点时恰好消耗Na2S2O3标准溶液40.00mL,计算本实验的产率为80.00%.
(2Co3++2I-═2Co2++I2,I2+2S2O32-═2I-+S4O62-)
分析 (1)由仪器结构特征,可知仪器a为锥形瓶;打开分液漏斗的玻璃塞,平衡分液漏斗内压强,逐滴加入过氧化氢;
(2)操作X是从热的滤液中分离得到晶体,应采取冷却结晶、过滤方法;
(3)活性炭没有参与反应,应是起催化剂作用;
(4)加入盐酸,借助同离子效应利用产品析出,冷水浴可以减少产品溶解损失;
(5)[Co(NH3)6]Cl3难溶于乙醇,微溶于盐酸,稍溶于水,应先用盐酸洗涤,再用乙醇洗,减少产品溶解损失;
(6)温度过高时产品为分解,温度过低干燥时间过长;
(7)根据Co原子守恒计算理论上生成[Co(NH3)6]Cl3的物质的量,根据关系式:2[Co(NH3)6]Cl3~2Co3++~I2~2S2O32-计算样品中[Co(NH3)6]Cl3的物质的量,进而计算产率.
解答 解:(1)由仪器结构特征,可知仪器a为锥形瓶;加入双氧水的操作方法是:打开分液漏斗的玻璃塞,再旋转玻璃活塞,逐滴加入过氧化氢,
故答案为:锥形瓶;打开分液漏斗的玻璃塞,再旋转玻璃活塞,逐滴加入过氧化氢;
(2)操作X是从热的滤液中分离出[Co(NH3)6]Cl3晶体,应采取冷却结晶、过滤方法,
故答案为:冷却结晶、过滤;
(3)活性炭没有参与反应,应是起催化剂作用,
故答案为:催化剂;
(4)提纯粗产品时,加入浓盐酸并冰水浴冷却的目的是:促进[Co(NH3)6]Cl3晶体析出,减少产品溶解损失,
故答案为:促进[Co(NH3)6]Cl3晶体析出,减少产品溶解损失;
(5)由于[Co(NH3)6]Cl3难溶于乙醇,微溶于盐酸,稍溶于水,增大氯离子浓度可以防止产品溶解而损失,应先用盐酸洗涤,再用乙醇洗,
故答案为:A;
(6)温度过高时产品易分解,温度过低干燥时间过长,再干燥成品时,一般采用沸水浴干燥的方式,便于控制温度,
故答案为:温度过高时产品易分解,温度过低干燥时间过长;
(7)11.9g CoCl2•6H2O的物质的量为$\frac{11.9g}{238g/mol}$=0.05mol,由Co原子守恒,故理论上生成[Co(NH3)6]Cl3为0.05mol,根据关系式:2[Co(NH3)6]Cl3~2Co3++~I2~2S2O32-,可知$\frac{M}{5}$g样品中[Co(NH3)6]Cl3的物质的量与消耗的S2O32-相等,故Mg药品中[Co(NH3)6]Cl3的物质的量为5×0.04L×0.2mol/L=0.04mol,故产率为$\frac{0.004mol}{0.05mol}$×100%=80.00%,
故答案为:80.00%.
点评 本题考查实验制备、化学仪器、对试剂与操作的分析评价、物质的分离提纯、滴定计算等,是对学生综合能力的考查,难度中等,(7)中计算结果注意有效数字.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | Al(OH)3═Al3++3OH- | B. | KHSO4═K++H++SO${\;}_{4}^{2-}$ | ||
| C. | CH3COOH?H++CH3COO- | D. | NaH2PO4?Na++H2PO${\;}_{4}^{-}$ |

(1)废钒催化剂需粉碎处理,目的是加快反应速率.
(2)填写并配平步骤②中的离子反应方程式.
6VO2++1C1O3-+6H2O=3V2O5↓+1Cl-+12H+;
(3)根据图二和下表信息,步骤②调节pH的合适范围是2.0~2.5.
| 开始沉淀pH | 完全沉淀pH | |
| Fe(OH)2 | 6.5 | 9.7 |
| Fe(OH)3 | 2.5 | 3.7 |
(4)V2O5和NaOH溶液反应的化学方程式为V2O5+2NaOH=2NaVO3+H2O.
(5)步骤④中需加人硫酸,其原因是使NH4+的水解平衡向逆方向移动,增加NH4+的离子浓度,增加NH4VO3的产量.
(6)焙烧产生的气体用硫酸吸收后,其产物可以在该工艺中循环利用.
(7)V2O5可制成某电池的电解液.该电池的总反应为:VO2++2H++V2+?V3+VO2++H2O,则放电时的负极产物为V3+.
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出 | |
| C. | 实验室制取乙烯时将温度计的水银球放在反应液面上,温度 170℃时收集气体 | |
| D. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
| A. | 酸性溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 碱性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
| A. | 鸡蛋清和淀粉可以用浓硝酸鉴别 | |
| B. | 用甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| C. | 分子式为C5H8O2,既与碳酸钠溶液反应又与溴的四氯化碳溶液反应的有机物有8种 | |
| D. | 乳酸薄荷醇酯(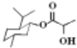 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 |
 硝苯地平缓释片(简称NSRT)是一种用于治疗各种类型的高血压及心绞痛的新药,其结构式如图所示.下列关于硝苯地平缓释片的说法正确的是( )
硝苯地平缓释片(简称NSRT)是一种用于治疗各种类型的高血压及心绞痛的新药,其结构式如图所示.下列关于硝苯地平缓释片的说法正确的是( )| A. | NSRT的分子式为C18H17N2O6 | |
| B. | 1molNSRT在水溶液中最多能消耗2molNaOH | |
| C. | NSRT不能使酸性高锰酸钾溶液褪色 | |
| D. | 1mol NSRT在一定条件下能和7molH2发生加成反应 |