题目内容
【题目】请回答下列问题:
(1)纯水在T℃时,pH=6,该温度下0.1 molL-1 的NaOH 溶液中,由水电离出的c(OH-)=__________ molL-1。
(2)在25℃下;将amol·L-1的NaX溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HX 的电离常数 Ka=________。
(3)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-aKJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-bKJ·mol-1 (b>0)
若用标准状况下5. 6LCO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为_____ mol,放出的热量为_________ kJ(用含有a和b的代数式表示)。
(4)已知AgCl、Ag2CrO4 (砖红色) 的Ksp分别为2×10-10和2.0×10-12。分析化学中,测定含氯的中性溶液中Cl- 的含量,以K2CrO4作指示剂,用AgNO3溶液滴定。滴定过程中首先析出沉淀_________,当溶液中Cl- 恰好完全沉淀(浓度等于1.0×10-5 mol·L-1) 时,此时溶液中c(CrO42-)等于__________ molL-1。
【答案】 10-11 > (a-0.01)×10-5 0.5 ![]() AgCl 5×10-3
AgCl 5×10-3
【解析】本题主要考查溶液中的离子平衡。
(1)纯水在T℃时,pH=6,则Kw=c(H+)c(OH-)=1×10-12,该温度下0.1 molL-1的NaOH溶液中,由水电离出的c(OH-)=c(H+)=10-11molL-1。
(2)在25℃下;将amol·L-1的NaX溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,说明弱酸盐NaX剩余,则a>0.01;c(H+)=1×10-7molL-1,c(X-)=(a-0.01)/2molL-1,c(HX)=0.01/2molL-1,Ka=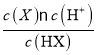 =(a-0.01)×10-5。
=(a-0.01)×10-5。
(3)2①+②得4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H=-(2a+b)KJ·mol-1,若用标准状况下5.6L即0.25molCO将NO2还原至N2(CO完全反应),CO~2e-,则整个过程中转移电子的物质的量为0.5mol,放出的热量为![]() kJ(用含有a和b的代数式表示)。
kJ(用含有a和b的代数式表示)。
(4)c(Cl-)较大,滴定过程中首先析出沉淀AgCl,当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,c(Ag+)= =2.0×10-5mol·L-1,此时溶液中c(CrO42-)=
=2.0×10-5mol·L-1,此时溶液中c(CrO42-)= =5×10-3molL-1。
=5×10-3molL-1。

【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。