题目内容
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
【答案】 HC2O4- AC c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) > = 5
【解析】本题主要考查弱酸的电离平衡。
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是K最大的微粒H2C2O4电离出H+后的酸根离子HC2O4-。
(2)A.溶液酸性减弱,故A变小;B.电离常数Ka= 不变,而c(CH3COO-)变小,故B增大;C.c(H+)变小,c(OH-)增大,故C变小;D.增大。故选AC。
不变,而c(CH3COO-)变小,故B增大;C.c(H+)变小,c(OH-)增大,故C变小;D.增大。故选AC。
(3)得到KHC2O4溶液,溶液中的变化: ![]()
![]() H++
H++![]() ,
, ![]() +H2O
+H2O![]() H2C2O4+OH-,H2O
H2C2O4+OH-,H2O![]() H++OH-。该溶液呈酸性,说明HC2O4-的电离程度大于水解程度,该溶液中各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。
H++OH-。该溶液呈酸性,说明HC2O4-的电离程度大于水解程度,该溶液中各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。
(4)由酸性:HClO<CH3COOH可得水解程度:NaClO>CH3COOK,所以pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa>NaClO,两溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(ClO-),c(K+)+c(H+)=c(OH-)+c(CH3COO-),因此,[c(Na+)-c(ClO-)]=[c(K+)-c(CH3COO-)]=c(OH-)-c(H+)。
(5)由Ka(CH3COOH)= 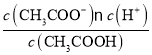 =1.8×10-5和c(CH3COOH):c(CH3COO-)=5:9得c(H+)=1×10-5mol/L,此时溶液pH=5。
=1.8×10-5和c(CH3COOH):c(CH3COO-)=5:9得c(H+)=1×10-5mol/L,此时溶液pH=5。

 一线名师提优试卷系列答案
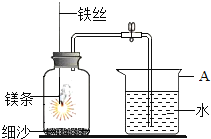
一线名师提优试卷系列答案【题目】碱式氯化镁(MgOHCl)常用作塑料添加剂,我国首创利用氢氧化镁与氯化铵热分解制氨气并得到碱式氯化镁的工艺。某科研小组根据该原理设计了如图实验装置制备碱式氧化镁并探究氨的还原性,反应前,装置C中CuO的质量为14.40g。
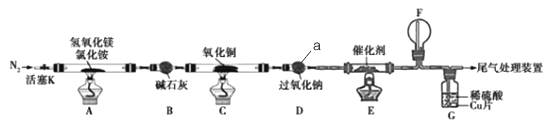
请回答下列问题:
(1)仪器a的名称是_______.
(2)装置A中发生反应的化学方程式为____________,装置B的作用是_________,装置D的作用是________
(3)装置G中的现象为____________
(4)反应结束后装置C中的氧化铜完全反应生成红色固体,并测得其质量为12.24g。则红色固体是______(填化学式),该反应中转移电子的物质的量为_______mol.
(5)完成下列实验方案,证明装置C中完全反应后得到的红色固体中含有氧化亚铜(供选择的试剂:2mol/L的HNO3溶液、2mol/L的H2SO4溶液、2mol/L的NaOH溶液)。
已知:Cu2O+2H+=Cu2++Cu+H2O.
实验步骤 | 预期现象和结论 |
步骤1取装置C中所得红色固体于大试管中 | ----- |
步骤2:_____________________________ | _______________ |