题目内容
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价电子排布式为_________________。
(2)C2F4可用于合成聚四氟乙烯,HBF4可用于蚀刻玻璃,NO2F可用作火箭推进剂中的氧化剂,NaAlF6可用作电冶铝的助培剂。
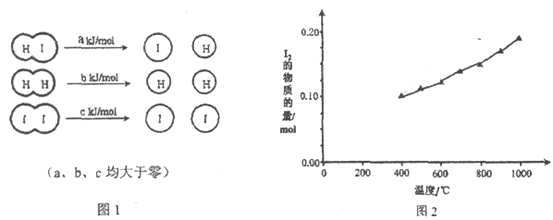
①C2F4分子中所含共价键的类型有_____,C2F4分子中碳原子的杂化轨道类型是____,聚四氟乙烯是一种准晶体,证明它不是晶体可用的实验方法是_______________。
②HF与BF3化合可得到HBF4,从价键形成角度分析HF与BF3能化合的原因_______________。
③与NO2F分子互为等电子的非极性分子有__________(写一个符合要求的化学式即可)。
(3)CaF2的晶体结构如图所示。
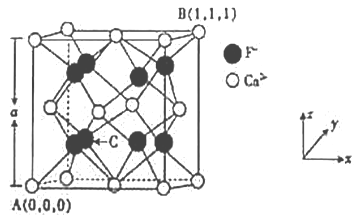
①CaF2晶胞中,Ca2+的配位数为_____;F-的配位数为_____。
②原子坐标参数可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为______________。
③晶胞参数可描述晶胞的大小和形状,CaF2晶胞的晶胞参数。A=546.2pm,则其密度为_____(列出计算式即可)g/cm3。
【答案】 2s22p5 σ键,π键 sp2 X射线衔射 BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键 BF3(或BCl3、SO3等) 8 4 ![]()
![]()
【解析】(1)F为9号元素,基态氟原子的价电子排布式为2s22p5,故答案为:2s22p5;
(2)①C2F4分子的结构类似于乙烯,所含共价键的类型有C-F间的σ键和C=C中的σ键和π键;C2F4分子为平面形状,碳原子的杂化轨道类型为sp2,聚四氟乙烯是一种准晶体,可以通过X射线衍射实验证明它不是晶体,故答案为:σ键,π键;sp2;X射线衍射;
②BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键,因此HF与BF3化合可得到HBF4,故答案为:BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键;
③与NO2F分子互为等电子的非极性分子有BF3(或BCl3、SO3等),故答案为:BF3(或BCl3、SO3等);
(3)①根据CaF2晶胞结构,每个F-周围有4个距离相等且最近的Ca2+,这4个钙离子构成正四面体结构,F-的配位数为4,在CaF2晶胞中Ca2+与F-的个数比为1:2,则Ca2+的配位数为8,故答案为:8;4;
②根据CaF2的晶体结构,氟离子分布在晶胞内,A、B原子的坐标参数依次为(0,0,0)、 (1,1,1),氟离子分布在晶胞内,8个氟离子构成立方体结构,每侧的4个负离子所在平面距离最近的晶胞的侧面为晶胞边长的![]() ,因此C点的原子坐标参数为(
,因此C点的原子坐标参数为(![]() ,
, ![]() ,
, ![]() ),故答案为:(
),故答案为:(![]() ,
, ![]() ,
, ![]() );
);
③根据CaF2晶胞结构,晶胞中含有8个氟离子,则含有4个钙离子,晶胞参数A=546.2pm,则其密度为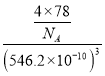 g/cm3=
g/cm3=![]() g/cm3=
g/cm3=![]() g/cm3,故答案为:
g/cm3,故答案为: ![]() 。
。

 考前必练系列答案
考前必练系列答案【题目】碱式氯化镁(MgOHCl)常用作塑料添加剂,我国首创利用氢氧化镁与氯化铵热分解制氨气并得到碱式氯化镁的工艺。某科研小组根据该原理设计了如图实验装置制备碱式氧化镁并探究氨的还原性,反应前,装置C中CuO的质量为14.40g。
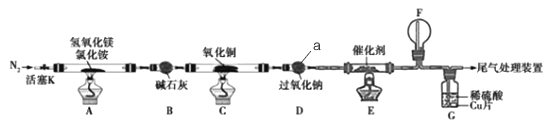
请回答下列问题:
(1)仪器a的名称是_______.
(2)装置A中发生反应的化学方程式为____________,装置B的作用是_________,装置D的作用是________
(3)装置G中的现象为____________
(4)反应结束后装置C中的氧化铜完全反应生成红色固体,并测得其质量为12.24g。则红色固体是______(填化学式),该反应中转移电子的物质的量为_______mol.
(5)完成下列实验方案,证明装置C中完全反应后得到的红色固体中含有氧化亚铜(供选择的试剂:2mol/L的HNO3溶液、2mol/L的H2SO4溶液、2mol/L的NaOH溶液)。
已知:Cu2O+2H+=Cu2++Cu+H2O.
实验步骤 | 预期现象和结论 |
步骤1取装置C中所得红色固体于大试管中 | ----- |
步骤2:_____________________________ | _______________ |