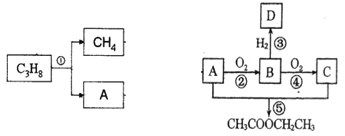
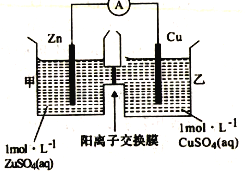
题目内容
【题目】高锰酸钾常用作消毒剂、水质净化剂等。工业上用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)制备高锰酸钾晶体的一种工艺流程如下:

回答下列问题:
(1)焙烧过程中发生的主要反应为MnO2+KOH+O2![]() K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
(2)滤渣Ⅱ是________,第一次通CO2不能用稀盐酸代替的原因是____________________________。
(3)第二次通入过量CO2生成MnO2的离子方程式为__________________________。
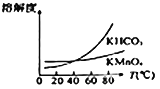
(4)由下图可知,从滤液Ⅲ得到高锰酸钾晶体需经过________、________、洗涤等一系列操作。
(5)1t含MnO287%的软锰矿,理论上最多可制得________tKMnO4晶体。
【答案】 2:1 加压,增大了氧气的浓度,反应速率加快,使MnO2反应更充分 Al(OH)3、H2SiO3 不易控制稀盐酸的用量,过量的稀盐酸会使Al(OH)3溶解(或酸性过强,会使K2MnO4过早发生歧化反应) 3MnO42-+4CO2+2H2O=MnO2↓+2MnO4-+4HCO3- 蒸发结晶 趁热过滤 1.58
【解析】分析整个流程,将软锰矿主要成分MnO2与KOH混合在空气中焙烧,冷却得到固体物质,将固体物质溶于水过滤得到滤渣I和滤液I,滤液I中应含有K2SiO3,KAl(OH)4,K2MnO4等溶质,滤渣I为Fe2O3;向滤液I中第一次通入CO2发生反应,过滤得到滤渣Ⅱ和滤液Ⅱ,滤渣Ⅱ为Al(OH)3,H2SiO3;滤液Ⅱ含有KHCO3,K2MnO4等溶质;向滤液Ⅱ中第二次通入过量CO2,再次过滤得到滤液Ⅲ和MnO2,则可以推断滤液Ⅲ中含有KMnO4和KHCO3,再经过一系列操作得到较纯的KMnO4,MnO2可以作为循环利用的物质。
(1)焙烧时MnO2与KOH在空气中O2的作用下反应得到K2MnO4和H2O,反应为氧化还原反应,Mn化合价升高2,O化合价降低2,根据电子转移数守恒,所以在MnO2前面配上2,O2前面配上1,配平后MnO2与O2的系数比为2:1;工业生产中采用对空气加压的方法提高MnO2利用率,用碰撞理论可以解释为加压增大了氧气浓度使单位体积内的活化分子数增加,有效碰撞数增多,反应速率加快,使MnO2反应更充分,故答案为:2:1;加压增大了氧气浓度,使单位体积内的活化分子数增加,有效碰撞数增多,反应速率加快,使MnO2反应更充分;
(2)滤渣Ⅱ中含有的物质有Al(OH)3,H2SiO3,第一次通CO2不能用稀盐酸代替,这是由于稀盐酸酸性较强,可溶解Al(OH)3,不易控制稀盐酸的用量,溶液中便会再次混入Al3+,故答案为:Al(OH)3,H2SiO3;不易控制稀盐酸的用量,过量的稀盐酸会使Al(OH)3溶解;
(3)第二次通入过量CO2生成MnO2,溶液中原先是K2MnO4,再第二次通入过量的CO2时发生歧化反应生成MnO2和KMnO4,此时CO2被转化为HCO3-,反应为氧化还原反应,则反应的离子方程式为:3MnO42-+4CO2+2H2O═MnO2↓+2MnO4-+4HCO3-,故答案为:3MnO42-+4CO2+2H2O═MnO2↓+2MnO4-+4HCO3-;
(4)将滤液Ⅲ进行一系列操作得KMnO4,此时溶液中还存在KHCO3,根据溶解度随温度变化的图像分析,随着温度升高,二者溶解度均不断增大,在40℃附近时二者溶解度相等,超过这一温度时,KHCO3溶解度不断增大,KMnO4溶解度则增大较缓慢,所以从溶液中提取较纯的KMnO4,需要蒸发结晶,趁热过滤,洗涤等操作,故答案为:蒸发结晶;趁热过滤;
(5)工业上按上述流程连续生产,含MnO287%的软锰矿1吨,理论上第一步完全转化为K2MnO4,第二步转化为KMnO4时则是发生歧化反应,由于歧化反应产物得到MnO2可以循环使用,所以理论最多产量则是根据Mn元素守恒完全生成KMnO4的量,为![]() =1.58t,故答案为:1.58。
=1.58t,故答案为:1.58。